température
Sous sa forme évoluée de grandeur mesurable, facteur de tension de l’énergie calorifique.
Généralités
La température a son origine dans la sensation physiologique qui nous fait dire au contact d’un corps que celui-ci est chaud ou froid ; sensation grossière et sujette à des erreurs, mais qui nous indique le sens de la variation de température, pourvu que celle-ci soit importante.
Pour un repérage plus précis de la température, on s’adresse à l’une des modifications des corps, que l’on attribue à une variation de température : dilatation, variation de la résistance électrique, de la pression de vapeur saturante, de la f. é. m. de contact, etc. L’une quelconque de ces modifications, relative à un échantillon donné de substance, peut servir à la définition d’une échelle de repérage des températures, par établissement d’un tableau de correspondance conventionnelle entre les valeurs de la modification considérée et celles que l’on désire attribuer à la température. Le thermomètre ainsi constitué permet alors de repérer, dans sa propre échelle, la température d’autres corps, cela en profitant de la constatation expérimentale suivant laquelle deux corps mis en contact tendent à égaliser leurs températures.
Au lieu de dresser un simple tableau de correspondance, il est préférable de faire choix d’une relation t = f (g), t étant la température et g la grandeur (mesurable) de la modification considérée ; ce choix est en principe arbitraire. Il est cependant commode de choisir la forme linéaire : t = A · g + B ; il suffit alors, pour déterminer complètement l’échelle, d’attribuer conventionnellement une valeur à deux températures bien définies et reproductibles, comme le sont celles de changement d’état d’un corps pur, qui constituent ce qu’on appelle des points fixes. Le point de fusion de la glace et le point d’ébullition de l’eau, observés sous la pression atmosphérique normale et notés respectivement 0 et 100, ont été à la base de la définition des échelles centésimales.
Soient g0 et g100 les valeurs de g pour l’échantillon choisi comme thermomètre et pour les points fixes 0 et 100. On a :
0 = A · g0 + B et 100 = A · g100 + B,
d’où :
et, par suite,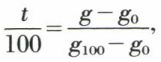
forme commode et suggestive de l’équation thermométrique sur laquelle on voit que les variations de t sont proportionnelles à celles de g. On peut également écrire
est le coefficient thermométrique dont la signification physique dépend du type de thermomètre. On définit alors un degré centésimal : variation de température qui produit la centième partie de la variation de la grandeur g constatée entre 0 et 100.
Parmi les thermomètres dont la graduation est pratiquement centésimale, et largement utilisés dans la pratique courante, au laboratoire, dans l’industrie, en médecine, etc., figurent les thermomètres à dilatation apparente de liquide (eau, alcool, pentane et surtout mercure) dans une enveloppe de verre ou parfois de silice fondue : ce sont des appareils commodes et peu encombrants, dont la sensibilité est d’autant plus grande que la tige capillaire est plus fine et le réservoir plus gros, et qui donnent par simple lecture une valeur de la température, suffisamment précise pour de nombreux usages. Cependant leur emploi comme thermomètres d’extrême précision se heurte à de nombreuses difficultés et nécessite des corrections ; de plus, leur échelle, en dehors des points 0 et 100, est plus ou moins différente de l’échelle légale (v. plus loin) ; enfin, le domaine d’utilisation de chacun d’eux est assez restreint.
Thermomètre à gaz
La dilatation des gaz est importante, ce qui fait espérer une grande sensibilité. L’observation précise de la dilatation sous pression constante présentant des difficultés, on préfère observer l’augmentation de pression du gaz sous volume constant, dont le coefficient thermométrique  est sensiblement égal au coefficient moyen de dilatation du gaz. L’un des inconvénients de ces thermomètres, par ailleurs précis et fidèles, est leur encombrement. De plus, leur maniement est délicat, les mesures longues ; cela limite leur emploi à des opérations bien déterminées et peu nombreuses. Le type le plus important en est le thermomètre à hydrogène à volume constant (pression de remplissage du réservoir : 1 m de mercure à 0 °C), dit « thermomètre normal ».
est sensiblement égal au coefficient moyen de dilatation du gaz. L’un des inconvénients de ces thermomètres, par ailleurs précis et fidèles, est leur encombrement. De plus, leur maniement est délicat, les mesures longues ; cela limite leur emploi à des opérations bien déterminées et peu nombreuses. Le type le plus important en est le thermomètre à hydrogène à volume constant (pression de remplissage du réservoir : 1 m de mercure à 0 °C), dit « thermomètre normal ».
L’hydrogène a été choisi, en particulier parce qu’il est, dans les conditions ordinaires, très éloigné de sa liquéfaction. On peut cependant utiliser d’autres gaz ; c’est pour constater, là encore, que les échelles centésimales ne coïncident pas tout à fait en dehors des points 0 et 100. Mais les échelles des différents thermomètres à gaz se rapprochent et tendent à se confondre entre elles quand on fait tendre vers zéro la pression de remplissage de ces thermomètres. Le coefficient thermométrique devient à la limite le même pour tous. Sa valeur a été déterminée avec précision ; c’est βlim = 0,003 661 = 1/273,15. Ainsi, quand on fait tendre vers zéro la pression de remplissage d’un thermomètre à gaz à volume constant, l’échelle thermométrique qu’il définit se modifie et tend vers une échelle limite indépendante du gaz. Cette échelle limite est dite « échelle centésimale du gaz parfait ».
Échelle absolue du gaz parfait
Si on pose que le gaz parfait ne se liquéfie pas, l’échelle précédente est définie pour toute valeur de la pression supérieure à zéro, c’est-à-dire pour  Posons Θ = t + 273,15, et nous obtenons l’échelle absolue du gaz parfait (appelée quelquefois échelle Avogadro), définie par la relation p = p0 βlim Θ ; celle-ci ne comporte pas de nombres négatifs ; son intérêt provient essentiellement de ce qu’elle se confond avec l’une des échelles thermodynamiques de températures : il résulte en effet de la définition de l’échelle absolue Θ que l’équation d’état d’un gaz parfait est, pour n moles, pv = nRΘ. Quant aux échelles thermodynamiques T, elles ont été définies par W. Thomson (v. thermodynamique), et il résulte de leur définition que le rendement de Carnot d’un moteur ditherme est ρm = 1 – T2/T1, T1 et T2 étant les températures thermodynamiques des sources, respectivement chaude et froide, températures que nous notons Θ1 et Θ2 dans l’échelle absolue. Considérons donc un moteur thermique dont l’agent d’évolution est une mole d’un gaz parfait décrivant un cycle de Carnot ABCD (figure) dans le sens horaire, producteur de travail ; T1, (Θ1), T2, (Θ2) sont les températures des sources, chaude et froide. Le rendement du moteur est 1 – T2/T1. Mais c’est aussi 1 + Q2/Q1, Q1 et Q2 étant les chaleurs reçues par le gaz parfait le long des portions AB et CD d’isothermes. Or, le long de AB par exemple, le gaz parfait, dont l’énergie interne ne varie pas puisque sa température est constante, reçoit une quantité de chaleur équivalente au travail de détente isotherme qu’il fournit, soit :
Posons Θ = t + 273,15, et nous obtenons l’échelle absolue du gaz parfait (appelée quelquefois échelle Avogadro), définie par la relation p = p0 βlim Θ ; celle-ci ne comporte pas de nombres négatifs ; son intérêt provient essentiellement de ce qu’elle se confond avec l’une des échelles thermodynamiques de températures : il résulte en effet de la définition de l’échelle absolue Θ que l’équation d’état d’un gaz parfait est, pour n moles, pv = nRΘ. Quant aux échelles thermodynamiques T, elles ont été définies par W. Thomson (v. thermodynamique), et il résulte de leur définition que le rendement de Carnot d’un moteur ditherme est ρm = 1 – T2/T1, T1 et T2 étant les températures thermodynamiques des sources, respectivement chaude et froide, températures que nous notons Θ1 et Θ2 dans l’échelle absolue. Considérons donc un moteur thermique dont l’agent d’évolution est une mole d’un gaz parfait décrivant un cycle de Carnot ABCD (figure) dans le sens horaire, producteur de travail ; T1, (Θ1), T2, (Θ2) sont les températures des sources, chaude et froide. Le rendement du moteur est 1 – T2/T1. Mais c’est aussi 1 + Q2/Q1, Q1 et Q2 étant les chaleurs reçues par le gaz parfait le long des portions AB et CD d’isothermes. Or, le long de AB par exemple, le gaz parfait, dont l’énergie interne ne varie pas puisque sa température est constante, reçoit une quantité de chaleur équivalente au travail de détente isotherme qu’il fournit, soit :
De même, le long de CD, le gaz reçoit :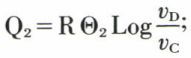
(vD < vC, Q2 négatif). On a dès lors :
Mais il est aisé de voir que l’on a vC/vD = vB/vA, car :
équations dont la combinaison fournit immédiatement la relation annoncée. En égalant les deux valeurs du rendement, on a donc  ce qui démontre la proposition : il y a proportionnalité entre l’échelle absolue du gaz parfait et l’une quelconque des échelles thermodynamiques, et on assurera l’identité avec l’une d’entre elles en attribuant, pour une certaine température bien définie, la même valeur dans l’échelle thermodynamique et dans celle du gaz parfait. On a choisi pour cela le point triple de l’eau, noté 273,16. Cette convention revient à définir, pour la grandeur mesurable que constitue la température thermodynamique, une unité : fraction
ce qui démontre la proposition : il y a proportionnalité entre l’échelle absolue du gaz parfait et l’une quelconque des échelles thermodynamiques, et on assurera l’identité avec l’une d’entre elles en attribuant, pour une certaine température bien définie, la même valeur dans l’échelle thermodynamique et dans celle du gaz parfait. On a choisi pour cela le point triple de l’eau, noté 273,16. Cette convention revient à définir, pour la grandeur mesurable que constitue la température thermodynamique, une unité : fraction  de la température thermodynamique du point triple de l’eau ; cette unité, le kelvin* (symbole K), est une unité de base du système international (S.I.). On définit à partir de là l’échelle Celsius, notée t, par une translation d’origine, en posant t = T – 273,15. Le degré Celsius, symbole °C, est égal au kelvin, et, dans l’échelle Celsius, la température du point triple de l’eau est 0,01 °C.
de la température thermodynamique du point triple de l’eau ; cette unité, le kelvin* (symbole K), est une unité de base du système international (S.I.). On définit à partir de là l’échelle Celsius, notée t, par une translation d’origine, en posant t = T – 273,15. Le degré Celsius, symbole °C, est égal au kelvin, et, dans l’échelle Celsius, la température du point triple de l’eau est 0,01 °C.




