atome (suite)
L’électron
L’électricité fut d’abord considérée comme une sorte de fluide, mais les travaux de Faraday* sur l’électrolyse montrèrent que l’électricité était associée en quantité définie à la matière dans des ions, anions et cations. Faraday croyait que tous les ions ont en valeur absolue la même charge électrique, et de cette théorie dite « des équivalents » résultaient des formules telles que HO pour l’eau ; cependant, les efforts patients des chimistes montrèrent que ce système des équivalents ne pouvait être maintenu ; l’hypothèse d’Avogadro contribua puissamment à l’abandon du système des équivalents pour celui, actuel, des poids atomiques. On se rendit compte alors que les ions, suivant leur nature matérielle, pouvaient porter une charge égale, en valeur absolue, à celle de l’ion hydrogène, ou une charge double, triple... de celle-ci ; l’Irlandais George Stoney (1826-1911) suggéra qu’il devait exister une charge électrique indépendante de la matière qui la porte, et c’est lui qui proposa de donner à cette unité de charge le nom d’électron. À la suite de la découverte des rayons cathodiques, l’étude de leurs propriétés amena Jean Perrin à considérer ces rayons comme des particules chargées d’électricité négative ; J. J. Thomson* détermina pour ces particules, en mesurant leur déviation par des champs électrique et magnétique, le rapport e/m de leur charge à leur masse et le trouva égal, en valeur absolue, à la 1/1 836 partie de celui qui est relatif à l’ion hydrogène. Tout cela suggérait l’existence d’une particule de charge égale et opposée à celle de l’ion hydrogène, et de masse 1 836 fois plus faible. La charge de l’ion hydrogène est déterminée par électrolyse et donnée par le rapport F/N du faraday, qui vaut 96 485 coulombs, au nombre d’Avogadro N = 6,022 4.1023 : e = 1,6021.10–19 C ; c’est, en valeur absolue, la charge de l’électron, qui peut être déterminée par d’autres méthodes, toutes concordantes ; en particulier, l’Américain Millikan* montra de façon directe que toute charge électrique observable était un multiple entier d’une charge élémentaire, pour laquelle il trouva aussi la valeur e = 1,6.10–19 C. Le rapport e/m de la charge à la masse de l’électron ayant été trouvé égal à 1,758 8.1011 C/kg, la masse m de l’électron vaut donc 9,109 1.10–31 kg ; il s’agit là de la masse au repos de l’électron, car, lorsque l’électron est en mouvement rapide, il y a lieu d’apporter à ce résultat la correction de relativité.
Divers phénomènes, et en particulier l’étude détaillée des spectres d’émission des atomes, conduisent à admettre que l’électron tourne sur lui-même, à la façon d’une toupie ; l’électron possède de ce fait un moment cinétique dit « de spin », auquel la théorie quantique attribue les deux seules valeurs 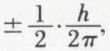 h étant la constante de Planck ; à chacune de ces valeurs on fait correspondre un nombre quantique dit « de spin s », attaché à l’électron et dont la valeur,
h étant la constante de Planck ; à chacune de ces valeurs on fait correspondre un nombre quantique dit « de spin s », attaché à l’électron et dont la valeur,  ou
ou  est liée au sens de rotation. Cette rotation conduit aussi à attribuer à l’électron, assimilable à un petit aimant, un moment magnétique.
est liée au sens de rotation. Cette rotation conduit aussi à attribuer à l’électron, assimilable à un petit aimant, un moment magnétique.
L’électron est un constituant fondamental des atomes ; les électrons, gravitant autour des noyaux, contribuent, pour une large part, à donner à la matière son aspect, ses propriétés et sa diversité. L’électron est aussi l’un des produits de la désintégration de certains noyaux d’atomes radio-actifs, dont il constitue le rayonnement β–.
Structure de l’atome
La découverte de la radio-activité, l’étude des rayonnements et des particules émis par la matière ayant prouvé, dès la fin du siècle dernier, la complexité de l’atome, le problème fut ainsi posé de la détermination de la composition interne et de la structure des atomes. Le modèle d’abord présenté fut celui de J. J. Thomson : ce physicien imaginait une sphère dans laquelle existait une distribution uniforme de charges positives réparties en une sorte de nuage ; dans ce nuage évoluaient des électrons ponctuels en nombre tel que l’ensemble fût neutre. La force qui sollicitait ces électrons étant ici centripète et de module proportionnel à la distance au centre, ceux-ci pouvaient effectuer des oscillations harmoniques, dans lesquelles Thomson voyait l’origine des spectres d’émission des éléments ; la confrontation avec les données expérimentales permettait d’évaluer un ordre de grandeur du diamètre de l’atome : 10–10 m, soit 1 Å dans le cas de l’hydrogène. Le modèle de Thomson ne devait cependant pas résister au verdict de l’expérience : lord Rutherford eut en effet, en 1909, l’idée de soumettre de minces feuilles métalliques au bombardement de particules α, c’est-à-dire de noyaux d’hélium animés de vitesses de l’ordre de 10 000 km/s, émises par un fragment de polonium ; alors que le modèle atomique de Thomson permettait de prévoir seulement de très petites déviations de ces particules à la traversée de la feuille, Rutherford observa avec stupéfaction une proportion non négligeable de déviations importantes et même que certaines particules α étaient renvoyées vers l’arrière ! Cela impliquait une collision — d’ailleurs très rare — de la particule α avec une particule positive de masse relativement élevée et de dimensions très petites. Ainsi naquit dans l’esprit de Rutherford l’idée du modèle d’atome dit « planétaire », à cause de l’analogie que celui-ci offre avec le système solaire. L’atome est constitué : d’une part, d’un noyau positif très petit, dans lequel est concentrée la charge positive de l’atome et la presque totalité de sa masse ; d’autre part, d’électrons gravitant autour du noyau à des distances très grandes par rapport aux dimensions des particules ; l’ensemble est évidemment électriquement neutre. L’étude quantitative des déviations des rayons α — ceux-ci provoquaient, après contact avec la feuille métallique, la luminescence ponctuelle d’un écran au sulfure de zinc — permet en particulier une estimation des dimensions du noyau : 10–14 à 10–15 m, c’est-à-dire environ la dix-millième partie de la dimension de l’atome ; l’aspect éminemment lacunaire de la matière est un des résultats les plus saisissants de ces expériences, demeurées célèbres ; il est classique de dire que, si, par un grossissement convenable de l’atome d’hydrogène, ses dimensions devenaient égales à celles du globe terrestre, le noyau, ici le proton, situé au centre, aurait un diamètre de 760 m seulement, alors que l’unique électron qui l’accompagne graviterait sur une orbite de 6 400 km de rayon ! Il est également classique de faire remarquer l’extraordinaire densité qu’aurait la matière si tous ses atomes « s’effondraient » jusqu’au contact des noyaux : environ 10 millions de tonnes par centimètre cube pour l’hydrogène !




