Composés renfermant un hydroxyle lié à un noyau aromatique et un groupe carboxylique. Selon que ce dernier est ou non directement relié au noyau, on peut en envisager deux séries.
Acides-phénols nucléaires
Ces composés ne se présentent pas à l’état libre dans le règne vivant, mais de nombreux hétérosides naturels les engendrent par hydrolyse. En ce qui concerne les synthèses, nous n’envisagerons que ceux d’entre eux qui dérivent du benzène : OH—C6H4—CO2H. On prévoit trois isomères :

Seul le dérivé ortho a reçu un nom vulgaire : acide salicylique (il existe à l’état de glucoside dans l’écorce du saule).
Les acides ortho et para se préparent généralement par la réaction de Kolbe : addition du gaz carbonique à un phénate alcalin et isomérisation thermique :

L’acide méta-hydroxybenzoïque se prépare généralement à partir de l’acide benzoïque, soit par oxydation en milieu alcalin, soit par nitration, réduction en acide méta-aminobenzoïque et diazotatation de ce dernier.
Les trois acides ont des propriétés physiques voisines : ce sont des solides bien cristallisés, très solubles dans l’eau bouillante et dans les alcools. Ils fondent sans décomposition.
L’acidité de l’hydrogène carboxylique est légèrement augmentée par la présence du groupe hydroxyle, mais l’acidité de l’hydrogène phénolique (dans le sel monobasique) est abaissée du fait du groupe  on ne connaît donc que les sels HO—C6H4—CO2Na, peu hydrolyses, et les sels NaOC6H4—CO2Na, très fortement hydrolysés.
on ne connaît donc que les sels HO—C6H4—CO2Na, peu hydrolyses, et les sels NaOC6H4—CO2Na, très fortement hydrolysés.
Par contre, on peut envisager trois types de dérivés méthylés :

Les premiers se préparent par estérification méthylique directe, les deuxièmes par action de CH3I sur le dérivé sodé des premiers, et les derniers par hydrolyse alcaline des deuxièmes.
Les acides-phénols sont le point de départ de nombreux colorants et de nombreux produits pharmaceutiques : antiseptiques comme le salol et le bétol ou analgésiques comme l’aspirine.
Acides-phénols non nucléaires
Plusieurs de leurs dérivés existent dans le règne vivant (coumarine de la fève tonka). Synthétiquement, les acides ortho- ou para-hydroxylés se préparent à partir des acides aromatiques non nucléaires

qui se nitrent en ortho et para.
Ces acides sont généralement cristallisés, et leur acidité ne dépasse pas celle des acides aliphatiques.
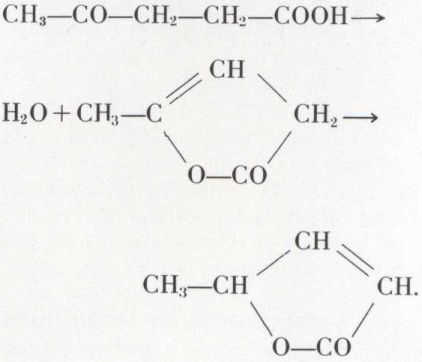
La caractéristique la plus intéressante des acides ortho-phénoliques est la lactonisation sous l’influence de la chaleur, ce qui suppose que n est compris entre 1 et 3 :

Si la chaîne est éthylénique, la lactonisation n’est possible que si la double liaison est de conformation « cis » ; elle est alors irréversible :


Mais les acides « trans » sont également déshydratables en milieu très acide, grâce à une trans-cis-conversion préalable ; tel est le principe de la synthèse de la coumarine (parfum) : on condense l’aldéhyde salicylique avec l’acétate de sodium en milieu anhydride acétique (réaction de Perkin) ; d’où l’acide coumarique « trans »

On isomérise par l’acide bromhydrique et l’acide coumarinique s’anhydrise.
Acides polyphénoliques
De nombreux hétérosides conduisent par hydrolyse à des acides polyphénols. Par exemple, l’hydrolyse des tanins libère l’acide gallique (du tanin de la galle du chêne) :

Ce dernier a des usages comme antiseptique (gallate de bismuth) et se condense avec lui-même pour former des colorants (acide rufigallique) ; il se décarboxyle par chauffage en un triphénol, le pyrogallol. Son sel ferrique constituait les anciennes encres noires.
C. P.








 on ne connaît donc que les sels HO—C6H4—CO2Na, peu hydrolyses, et les sels NaOC6H4—CO2Na, très fortement hydrolysés.
on ne connaît donc que les sels HO—C6H4—CO2Na, peu hydrolyses, et les sels NaOC6H4—CO2Na, très fortement hydrolysés.






