platine (suite)
Atomes
Ces six éléments constituent une triade de la deuxième série et une triade de la troisième série des éléments de transition. Ils sont ainsi six des neuf éléments du groupe VIII du tableau de Mendeleiev.
Il en résulte les numéros atomiques et les structures électroniques de l’état fondamental des atomes présentés dans le tableau suivant :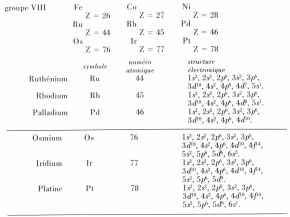
Il en résulte aussi les énergies successives suivantes d’ionisation :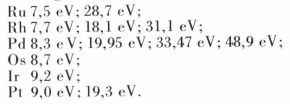
Il en résulte également les rayons atomiques suivants :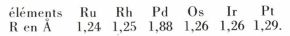
Par suite de ces caractéristiques atomiques, ces éléments ont de fortes ressemblances. Les rayons des cations Pd+2 et Pt+2 sont faibles : 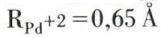 et
et 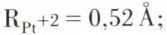 les composés de ces éléments contiennent très souvent des ions complexes ; de plus, malgré la valeur relativement modérée de l’énergie de première ionisation, qui est même plus faible que celle qui correspond à l’élément fortement électropositif qui est le zinc, les potentiels standards d’électrode
les composés de ces éléments contiennent très souvent des ions complexes ; de plus, malgré la valeur relativement modérée de l’énergie de première ionisation, qui est même plus faible que celle qui correspond à l’élément fortement électropositif qui est le zinc, les potentiels standards d’électrode 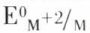 sont relativement élevés, ce qui est en partie dû à l’énergie élevée de sublimation.
sont relativement élevés, ce qui est en partie dû à l’énergie élevée de sublimation.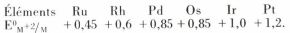
Le caractère noble de ces métaux est aussi accru par leur tendance à être « passives » : seuls le platine, l’osmium et le palladium sont solubles dans l’eau régale, et il se forme alors des ions complexes chlorés tels que 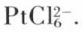
Corps simples
Les corps simples correspondant à ces éléments sont des métaux dont le tableau suivant donne le point de fusion et la densité :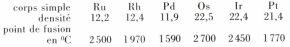
Ces métaux sont peu réactifs. Le platine ne réagit pas avec l’oxygène, le palladium se recouvre vers 600 à 800 °C d’une couche superficielle d’oxyde qui se décompose vers 1 000 °C, le rhodium s’oxyde au rouge, l’osmium brûle dans l’oxygène vers 400 °C en donnant le tétroxyde OsO4 volatil, qu’il est très dangereux de respirer. Tous les métaux réagissent, par contre, avec le chlore, et certains dès 400 °C. Le platine et le palladium ont des propriétés catalytiques souvent utilisées pour réaliser des hydrogénations, et l’on réalise aussi des oxydations avec le platine. La résistance à la corrosion a conduit à utiliser le platine pour confectionner des creusets et des électrodes.
La préparation de ces métaux à l’état pur comporte une série de séparations à partir de l’attaque de leurs minerais complexes par l’eau régale.
Le platine, le palladium ainsi que l’or (et à un moindre degré l’argent) sont considérés comme des métaux précieux vu leur rareté et leur bonne conservation dans les conditions ordinaires.
Principaux dérivés
Avec le rhodium et l’iridium, on rencontre surtout des dérivés rattachés aux nombres suivants d’oxydation :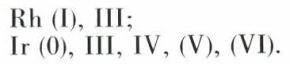
Le palladium et le platine présentent des analogies plus grandes avec le nickel qu’il n’en existe entre les autres éléments de ce groupe du platine et les éléments correspondants de la première triade : ainsi, le nickel et le palladium donnent généralement des dérivés liés au nombre d’oxydation II, et le platine, seul, donne des familles de dérivés également importantes reliées aux nombres d’oxydation II et IV.
Le ruthénium et l’osmium manifestent une parenté avec le fer analogue à celle du molybdène et du tungstène avec le chrome. Ils donnent naissance à un ensemble de dérivés rattachés à une grande variété de nombres d’oxydation (on a mis entre parenthèses les nombres d’oxydation les moins fréquents) :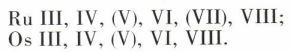
La plupart des halogénures peuvent être obtenus par combinaison directe. L’osmium et l’iridium, seuls, donnent des hexahalogénures (qui se limitent aux hexafluorures OsF6 et IrF6).
La plupart de ces halogénures sont fortement colorés ; ce sont des solides dont la volatilité croît généralement avec le nombre d’oxydation de l’élément de ces triades. On connaît aussi de nombreux complexes halogènes, en particulier avec la coordinence 6. Les principaux oxydes connus sont cités dans le tableau suivant :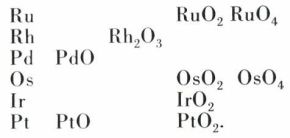
On connaît des ruthénates, tel K2RuO4 ; on a obtenu des produits de réaction entre OsO4 et des bases alcalines ; les sulfates de rhodium III et d’iridium III forment des aluns.
H. B.
R. Gadeau, Métaux non ferreux (A. Colin, 1959).




