physique (suite)
Dans un métal, le courant électrique est un courant d’électrons ; dans un électrolyte, c’est un courant d’ions, dont les charges sont des multiples entiers de la charge de l’électron. Par application des lois de Faraday, on déduit la valeur de la « charge élémentaire » (e = 1,602.10–19 coulomb) qui fut d’ailleurs déterminée directement en 1911 par Robert Andrews Millikan*.
• Rayons X. En 1895, l’Allemand Wilhelm Conrad Röntgen* découvrit les rayons X et étudia leurs propriétés, mais leur nature ne fut connue d’une manière péremptoire qu’en 1912, à partir des expériences de Max von Laue* sur leur diffraction par les cristaux.
• Radioactivité*. Découverte par Henri Becquerel*, qui constata que des plaques photographiques étaient impressionnées au voisinage d’un sel d’urane, la radioactivité fut étudiée par Pierre et Marie Curie*, qui découvrirent le polonium et le radium. Les transformations radioactives, véritables transmutations, sont accompagnées de trois types de rayonnement : le rayonnement α, identifié par Ernest Rutherford*, est constitué par des noyaux d’hélium ; le rayonnement β est formé d’électrons ; le rayonnement γ, identifié par Paul Ulrich Villard (1860-1934), est analogue au rayonnement X, mais de plus faible longueur d’onde. En 1934, Irène et Frédéric Joliot-Curie* découvrirent la radioactivité artificielle.
• La théorie des quanta. Elle permit d’abord d’expliquer le rayonnement du corps noir, corps idéal, qui absorberait intégralement toutes les radiations qu’il reçoit et qui peut être approximativement réalisé par une enceinte fermée — à température constante, — percée d’une petite ouverture. Le rayonnement sortant de cette ouverture ne dépend que de la température ; il présente un spectre continu, le maximum d’émission se déplaçant vers les faibles longueurs d’onde quand la température croît. L’étude expérimentale fut faite par l’Autrichien Josef Stefan (1835-1893) et l’Allemand Wilhelm Wien (1864-1928) ; une théorie fondée sur la statistique de Boltzmann, proposée par John William Rayleigh (1842-1919), s’accorde avec l’expérience du côté des grandes longueurs d’onde, mais conduit à une valeur infinie de l’énergie émise dans le cas des courtes longueurs d’onde et ne peut convenir. En 1900, l’Allemand Max Planck* émit l’hypothèse audacieuse que l’énergie ne peut être émise ou absorbée que d’une manière discontinue, par sauts brusques, multiples entiers d’un quantum représentant un grain d’énergie W = hν, ν étant la fréquence du rayonnement et h une constante égale à 6,626.10–34 unités S. I. Cette hypothèse eut le double mérite de conduire à l’expression de la loi du rayonnement du corps noir et à la théorie des chaleurs massiques.
• L’effet photo-électrique. Il fut découvert en 1887 par Hertz ; extraction instantanée d’électrons d’une surface matérielle chargée négativement lorsqu’on l’éclaire par une lumière convenable, il resta inexpliqué jusqu’en 1905, date à laquelle Einstein admit que, dans toute radiation, chaque quantum d’énergie est transporté par un projectile appelé photon*. Si W0 est le travail d’extraction d’un électron de la surface éclairée, l’émission n’est possible, quelle que soit l’intensité du rayonnement, que si la fréquence lumineuse est au moins égale à 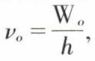 ce qui explique l’existence d’un seuil. En 1923, Arthur Holly Compton (1892-1962) confirma la validité de l’hypothèse du photon ; si l’on envoie des rayons X ou γ sur du graphite ou de la paraffine, il apparaît, diffusées dans toutes les directions, des radiations, dont les fréquences peuvent être calculées en admettant qu’il y a choc d’un photon sur un électron et que ce choc obéit aux mêmes lois que si le photon est une particule matérielle : le vecteur quantité de mouvement se conserve, et la fraction de l’énergie perdue par le photon est égale à l’énergie reçue par l’électron. Ce phénomène ne doit pas être confondu avec l’effet découvert en 1928 par Chandrasekhara Venkata Raman (1888-1970), qui consiste en une diffusion de la lumière avec changement de longueur d’onde, la différence des fréquences étant indépendante de celle du faisceau incident et caractéristique de la nature chimique du milieu diffusant.
ce qui explique l’existence d’un seuil. En 1923, Arthur Holly Compton (1892-1962) confirma la validité de l’hypothèse du photon ; si l’on envoie des rayons X ou γ sur du graphite ou de la paraffine, il apparaît, diffusées dans toutes les directions, des radiations, dont les fréquences peuvent être calculées en admettant qu’il y a choc d’un photon sur un électron et que ce choc obéit aux mêmes lois que si le photon est une particule matérielle : le vecteur quantité de mouvement se conserve, et la fraction de l’énergie perdue par le photon est égale à l’énergie reçue par l’électron. Ce phénomène ne doit pas être confondu avec l’effet découvert en 1928 par Chandrasekhara Venkata Raman (1888-1970), qui consiste en une diffusion de la lumière avec changement de longueur d’onde, la différence des fréquences étant indépendante de celle du faisceau incident et caractéristique de la nature chimique du milieu diffusant.
• L’atome de Bohr. Après William Thomson*, J. J. Thomson et E. Rutherford*, Niels Bohr* proposa en 1912-13 un modèle d’atome planétaire satisfaisant à la théorie des quanta. Un électron obéit à la dynamique newtonienne, mais ne peut décrire que des orbites pour lesquelles son moment cinétique est un multiple entier de 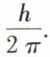 Sur de telles orbites, il ne rayonne pas ; il est dynamiquement stable et ne tend pas à tomber sur le noyau. L’énergie de l’atome ne peut prendre que des valeurs discrètes ; dans son « état fondamental », le plus stable, l’atome se trouve au niveau d’énergie minimal E1. Sous l’influence de certaines actions, telles qu’une décharge électrique, un électron passe à une autre orbite stable correspondant à une énergie plus élevée E2. Dans le retour à l’état initial ou à un état intermédiaire, l’énergie est restituée sous forme d’un rayonnement de fréquence
Sur de telles orbites, il ne rayonne pas ; il est dynamiquement stable et ne tend pas à tomber sur le noyau. L’énergie de l’atome ne peut prendre que des valeurs discrètes ; dans son « état fondamental », le plus stable, l’atome se trouve au niveau d’énergie minimal E1. Sous l’influence de certaines actions, telles qu’une décharge électrique, un électron passe à une autre orbite stable correspondant à une énergie plus élevée E2. Dans le retour à l’état initial ou à un état intermédiaire, l’énergie est restituée sous forme d’un rayonnement de fréquence 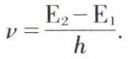 Dans le cas d’un atome d’hydrogène, les fréquences possibles sont telles que
Dans le cas d’un atome d’hydrogène, les fréquences possibles sont telles que 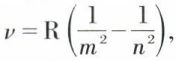 m et n étant deux nombres entiers, et R la constante de Rydberg, égale à 10 967 776 m–1.
m et n étant deux nombres entiers, et R la constante de Rydberg, égale à 10 967 776 m–1.
Le spin* de l’électron. Afin d’expliquer complètement l’effet Zeeman, George Eugene Uhlenbeck (né en 1900) et Samuel Abraham Goudsmit (né en 1902) émirent l’hypothèse que l’électron tourne sur lui-même, c’est-à-dire qu’il possède un moment cinétique, ou moment de spin. Étant une charge en rotation, il doit donc posséder un moment magnétique de valeur 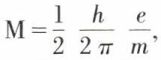 que l’on caractérise par le nombre
que l’on caractérise par le nombre 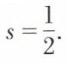 A priori on pose que deux électrons tournant en sens inverse ont des énergies différant entre elles d’un quantum, c’est-à-dire que le spin d’un électron ne peut prendre que les valeurs
A priori on pose que deux électrons tournant en sens inverse ont des énergies différant entre elles d’un quantum, c’est-à-dire que le spin d’un électron ne peut prendre que les valeurs 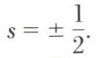 En 1921, les Allemands Otto Stern (1888-1969) et Walther Gerlach (né en 1889) constatèrent qu’un jet d’atomes d’argent lancé dans un champ magnétique non uniforme se subdivise en deux jets également déviés de part et d’autre de la direction initiale. Cela s’explique en admettant que l’atome d’argent possède un moment magnétique, le même que celui de l’électron périphérique et ne pouvant prendre que deux valeurs possibles. Cette expérience fournit en même temps une mesure acceptable du spin de l’électron.
En 1921, les Allemands Otto Stern (1888-1969) et Walther Gerlach (né en 1889) constatèrent qu’un jet d’atomes d’argent lancé dans un champ magnétique non uniforme se subdivise en deux jets également déviés de part et d’autre de la direction initiale. Cela s’explique en admettant que l’atome d’argent possède un moment magnétique, le même que celui de l’électron périphérique et ne pouvant prendre que deux valeurs possibles. Cette expérience fournit en même temps une mesure acceptable du spin de l’électron.




