phénols (suite)
• Réactions de l’hydrogène hydroxylique. Les phénols sont des acides faibles (PKA ≈ 10). Leurs sels alcalins, très solubles dans l’eau, sont faiblement hydrolysés, mais complètement décomposés par les acides ou par CO2 en présence d’eau :
ΦOK + CO2 + H2O → ΦOH + KHCO3 (cf. préparations).
Les phénols décomposent irréversiblement les alcoolates et les organomagnésiens :
Φ—OH + C2H5ONa → C2H5OH + ΦONa ;
Φ—OH + C2H5MgBr → C2H6 + ΦOMgBr.
Ces phénates permettent le passage aux éthers-oxydes :
ΦONa + CH3I → NaI + Φ—OCH3.
Comme les alcools, les phénols s’unissent à l’isocyanate de phényle :
Φ—OH + Φ—N=C=O → Φ—NH—CO—OΦ (phényluréthanne).
• Réactions de l’hydroxyle phénylique. Aucun acide, même HI, ne peut éthérifier un phénol ; par contre, PCl5 conduit à ce résultat :
ΦOH + PCl5 → HCl + OPCl3 + ΦCl.
Sur alumine à 350 °C, les phénols se déshydratent en éthers-oxydes :
2 ΦOH → H2O + Φ—O—Φ.
À 300 °C, l’aniline transforme le phénol en diphénylamine :
Φ—NH2 + ΦOH → H2O + Φ—NH—Φ.
L’inertie de l’hydroxyle phénolique diminue chez certains phénols à fonction mixte ; c’est le cas pour le trinitrophénol, ou acide picrique :
• Réactions du noyau. L’hydrogénation catalytique du phénol est plus facile que celle du benzène :
À température plus élevée, on peut arriver à la cyclohexanone.
Mais les propriétés essentielles du noyau résident dans l’extrême facilité des substitutions électrophiles ; celles-ci se font exclusivement aux positions en ortho et para de l’hydroxyle, et parfois 108 fois plus vite que sur le benzène.
À sec, le chlore se substitue concurremment en ortho et para, puis en ortho-para, enfin en 2-4-6.
En présence d’eau, on arrive directement au trichlorophénol ; la même réaction a lieu avec le brome et constitue un dosage du phénol.
L’acide sulfurique attaque successivement le phénol aux mêmes positions que le chlore ; il en est de même de l’acide nitrique. Le trinitrophénol, ou acide picrique, est un acide fort. C’est un colorant jaune médiocre, mais un explosif puissant employé en artillerie sous le nom de mélinite.
Le phénol peut être alcoylé sur le noyau soit par un alcool secondaire en présence de H2SO4, soit par un alcène en présence de BF3 ; l’alcoylation se fait en ortho et en para.
L’acide nitreux nitrose en para :
Si la place para (ou parfois la place en ortho) est libre, les diazoïques en milieu alcalin conduisent à des azophénols :
Ces azophénols forment le groupe des colorants azophénoliques, d’autant meilleurs, en général, que la molécule est plus lourde, donc plus insoluble.
Les substitutions électrophiles les plus importantes sont celles qui introduisent un radical carboné ; nous avons déjà vu l’alcoylation.
Les aldéhydes se condensent en ortho et para, réaction catalysée par les acides et par les alcalis. En première phase :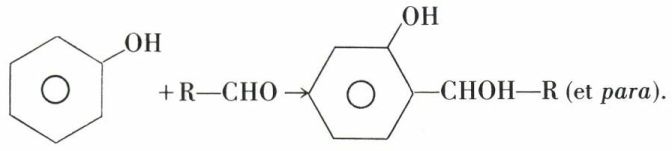
La condensation peut se renouveler, en milieu plus acide, aux places libres ortho et para :
Mais ce phénol triol se condense à lui-même, par élimination d’eau entre les hydroxyles, pour former une résine tridimensionnelle conduisant à des solides indéformables ; c’est le principe de la préparation des bakélites.
En présence d’acide chlorhydrique, les nitriles se condensent en ortho ou en para :
L’hydrolyse conduit à des cétones-phénols :
La condensation avec le chloroforme en milieu alcalin est particulièrement caractéristique :
Les fonctions quadrivalentes se comportent de la même façon :
Mais la carboxylation du noyau s’opère plus facilement grâce à la transposition de Kolbe.
Le phénol sodé, sec, absorbe, vers 100 °C, le gaz carbonique :
Φ—ONa + CO2 → Φ—O—COONa.
Vers 200 °C, ce carbonate mixte s’isomérise en salicylate de sodium :
Dans les mêmes conditions, le phénol potassé conduit surtout à l’isomère para.
• Oxydations. Les phénols sont assez facilement oxydés. On peut admettre que le premier terme est un hydroperoxyde qui s’isomérise en diphénol-para, lui-même facilement oxydable en quinone :
Mais la quinone est elle-même oxydable, d’abord en acide oxalique et acide maléique HOCO—CH=CH—CO2H et, finalement, en trois molécules d’acide oxalique. L’arrêt à l’acide maléique est l’une des préparations de ce diacide.
Si le phénol lui-même a été pris comme exemple dans l’exposé des réactions, celles-ci sont peu modifiées dans le cas des homologues ; cependant, les réactions de substitution dans le noyau supposent que l’une au moins des places en ortho ou en para de l’hydroxyle n’est pas occupée.
Les phénols ont une importance pratique considérable : matières premières de parfums, de produits pharmaceutiques, d’explosifs et surtout de colorants. Le phénol lui-même donne accès aux bakélites et, par l’intermédiaire du cyclohexanol, au Nylon.
C. P.




