isomorphisme (suite)
Une autre difficulté a trait à la précision liée à la notion de parenté des formes cristallines. Pour Mitscherlich, les corps isomorphes se présentent avec des formes cristallines identiques, et cette identité était pour lui le caractère fondamental de l’isomorphisme. Mais on s’est rapidement rendu compte, par des mesures au goniomètre optique, que les angles dièdres des faces des cristaux étaient simplement voisins. Ainsi, pour la série des carbonates rhomboédriques isomorphes, l’angle des clivages varie de 105 à 107°. L’analogie des formes cristallines, que l’on a désignée par homéomorphisme, demandait ainsi de fixer les limites de variation des angles dièdres. Puis on signala des cas de composés apparentés du point de vue chimique, homéomorphes, et ne syncristallisant pas. Un exemple simple est celui des chlorures de lithium LiCl, de sodium NaCl et de potassium KCl.
Enfin, des sels de formules chimiques analogues, non homéomorphes, peuvent syncristalliser. C’est le cas du sulfate ferreux monoclinique FeSO4 . 7H2O et du sulfate de zinc orthorhombique ZnSO4 . 7H2O, dont les cristaux sont très différents. Cependant, les solutions des deux sulfates peuvent donner naissance à deux séries distinctes de cristaux mixtes, les uns orthorhombiques, les autres monocliniques. L’explication se trouve dans les expériences suivantes : on ensemence une solution sursaturée de sulfate de fer avec un cristal de sulfate de zinc orthorhombique ; il se développe un cristal de fer orthorhombique et inversement, par le même procédé, on peut obtenir un cristal de sulfate de zinc monoclinique. On dit que les deux sulfates sont isodimorphes, c’est-à-dire qu’ils sont dimorphes et que l’une des formes, métastable dans les conditions ordinaires de température et de pression, est isomorphe de la phase stable de l’autre.
La plupart de ces difficultés qui opposaient souvent les chimistes et les cristallographes ont disparu après les recherches qui ont résulté de la découverte, en 1912, de la diffraction cristalline des rayons X par Laue*, suivie de l’établissement des structures atomiques des cristaux par W. H. et W. L. Bragg. C’est le Norvégien V. M. Goldschmidt qui est à l’origine de cette nouvelle cristallochimie. S’appuyant sur les données des rayons X qui fixent la position des atomes dans les cristaux, il envisage les composés minéraux, comme le faisait déjà Arrhenius*, comme des édifices d’ions qui s’attirent ou se repoussent suivant leur signe. Ces ions sont assimilables, dans une première approximation, à des sphères au contact que l’on retrouve identiques à elles-mêmes dans les différents composés, et Goldschmidt en a donné le premier, en 1924, les dimensions exactes. Par exemple, l’anion oxygène O2– a pour rayon 1,32 angström (1 angström, désigné par Å, vaut 10–8 cm), celui de fluor F– 1,33 Å ; pour les cations alcalins, Li+ 0,76, Na+ 0,98, K+ 1,33 Å.
À cette notion de rayon ionique, Viktor Moritz Goldschmidt associe celle de coordination. Un cation s’entoure d’anions dont le nombre définit sa coordination ; celle-ci dépend du rapport des rayons du cation et de l’anion. C’est ainsi que l’ion silicium Si4+, de rayon 0,42 Å, a pour voisins quatre ions oxygène aux sommets d’un tétraèdre régulier dont il occupe le centre. On le retrouve, presque sans déformation, dans toutes les silices et tous les silicates. Ces résultats ont clarifié les relations des trois propriétés suivantes : analogie cristallographique, analogie chimique et syncristallisation, qu’implique l’isomorphisme.
Eilhard Mitscherlich
Chimiste allemand (Neuende, Oldenburg, 1794 - Berlin 1863). Il énonça en 1820 la loi selon laquelle des corps isomorphes ont des compositions chimiques analogues et découvrit en 1834 les réactions de nitration et de sulfonation.
Analogie cristallographique et analogie chimique, isotypie
L’homéomorphisme, qui résulte des mesures au goniomètre des angles des faces des cristaux, traduit la parenté des formes primitives des cristaux d’où dérivent, par troncature, les différentes formes cristallines. Les rayons X fournissent les moyens de préciser avec plus de finesse les parentés cristallographiques. Leurs longueurs d’onde servent de repères pour mesurer les dimensions des mailles élémentaires. Si celles-ci sont voisines, il en résulte la propriété d’homéomorphisme. Mais les rayons X révèlent aussi l’arrangement des atomes à l’intérieur de la maille, c’est-à-dire du motif cristallin. Si différents composés ont des motifs comprenant le même nombre d’atomes, de même taille et de même arrangement, on dit alors qu’ils sont isotypes, et leurs propriétés cristallographiques sont très voisines. L’isotypie est donc une notion plus précise que l’homéomorphisme. Un exemple classique est celui de la calcite CaCO3 et du nitrate de sodium NaNO3, dont les cristaux sont rhomboédriques avec des formes cristallines quasi identiques. Ces deux sels ne sont pas isomorphes, mais isotypes. Les radicaux 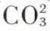 et NO3 sont plans avec les mêmes gros ions oxygène au contact et forment un triangle équilatéral dont la petite cavité centrale est occupée soit par l’atome de carbone C4+, soit par l’atome d’azote N5+ ; comme les cations Ca2+ et Na+ ont des rayons voisins, l’agencement géométrique des radicaux
et NO3 sont plans avec les mêmes gros ions oxygène au contact et forment un triangle équilatéral dont la petite cavité centrale est occupée soit par l’atome de carbone C4+, soit par l’atome d’azote N5+ ; comme les cations Ca2+ et Na+ ont des rayons voisins, l’agencement géométrique des radicaux  ou
ou  et des cations est le même dans les deux corps. Il en résulte une parenté étroite de certaines propriétés physiques, comme la forme des cristaux, les mêmes clivages, la même biréfringence optique liée à l’anisotropie des radicaux CO3 et NO3. Cependant, comme l’attraction coulombienne est quatre fois plus grande pour l’anion
et des cations est le même dans les deux corps. Il en résulte une parenté étroite de certaines propriétés physiques, comme la forme des cristaux, les mêmes clivages, la même biréfringence optique liée à l’anisotropie des radicaux CO3 et NO3. Cependant, comme l’attraction coulombienne est quatre fois plus grande pour l’anion  et Ca2+ que pour
et Ca2+ que pour  et Na+, la calcite est plus solide, plus dure, de point de fusion plus élevé que pour les cristaux de nitrate de sodium. Le silicate de zinc Zn2SiO4 et le fluorure double de béryllium et de lithium Li2BeF4 se présentent sous les mêmes formes de cristaux rhomboédriques. C’est que les gros anions O2– et F– ainsi que les cations les plus petits des deux composés, ayant des dimensions respectivement très voisines, présentent le même arrangement géométrique. Comme les charges électriques des ions diffèrent, le silicate est plus solide que le fluorure ; les duretés dans l’échelle de Mohs sont 5,5 pour l’un et 3,8 pour l’autre ; les points de fusion sont respectivement 1 500 et 470 °C.
et Na+, la calcite est plus solide, plus dure, de point de fusion plus élevé que pour les cristaux de nitrate de sodium. Le silicate de zinc Zn2SiO4 et le fluorure double de béryllium et de lithium Li2BeF4 se présentent sous les mêmes formes de cristaux rhomboédriques. C’est que les gros anions O2– et F– ainsi que les cations les plus petits des deux composés, ayant des dimensions respectivement très voisines, présentent le même arrangement géométrique. Comme les charges électriques des ions diffèrent, le silicate est plus solide que le fluorure ; les duretés dans l’échelle de Mohs sont 5,5 pour l’un et 3,8 pour l’autre ; les points de fusion sont respectivement 1 500 et 470 °C.




