atome (suite)
Par la suite, les notions d’atome et de molécule n’ont cessé de s’affermir et de se préciser, et nombreuses sont les découvertes physiques ou chimiques qui ont, directement ou non, apporté leur contribution à la théorie atomique et moléculaire. Citons en particulier la théorie cinétique des gaz, développée au cours du xixe s. par Boltzmann*, Maxwell*, Clausius* et d’autres, en partant de l’hypothèse que les gaz sont formés de molécules très petites, très nombreuses, animées de mouvements incessants et désordonnés : les lois expérimentales de compressibilité, de dilatation, de diffusion, de viscosité, etc., sont bien interprétées dans cette théorie.
La classification périodique des éléments, proposée en 1869 par le Russe Mendeleïev*, vint couronner les efforts des chimistes et, en même temps, leur suggérer que toute la matière de l’Univers pouvait bien être constituée à l’aide d’une centaine seulement d’atomes différents. Bien avant cela, il est vrai, l’Anglais William Prout avait émis l’hypothèse que les atomes des divers éléments étaient formés à partir du seul atome d’hydrogène, les poids atomiques des divers éléments étant en effet le plus souvent des multiples entiers de celui de l’hydrogène. Bien que simple et séduisante, cette hypothèse audacieuse avait dû être abandonnée ; mais on peut dire actuellement que, d’une certaine manière, elle se trouve confirmée. (V. noyau.)
Ainsi, à la fin du siècle dernier, on pouvait admettre qu’une grande majorité de physiciens et de chimistes étaient, plus ou moins ouvertement, acquis à l’atomisme, et certains pouvaient penser qu’on avait atteint dans ce domaine, avec les atomes insécables, les limites de la connaissance. Et pourtant...
L’étude de la décharge électrique dans les gaz raréfiés, la découverte des rayons cathodiques et celle de la radio-activité, ainsi que l’étude des rayonnements émis par les corps radio-actifs ne tardèrent pas à imposer l’idée de la complexité de l’atome et de son noyau ; disposant de moyens de plus en plus puissants pour disséquer l’atome, les physiciens ont, depuis le début du présent siècle, accumulé les découvertes et les résultats ; actuellement, si quelques points demeurent encore obscurs, il est cependant possible de donner de l’atome une description assez détaillée.
Le nombre d’Avogadro
Puisque toute matière est constituée d’atomes, une question vient immédiatement à l’esprit : quel est le nombre de ces atomes présents dans un poids donné d’un corps ? Ce nombre est ordinairement très grand, puisqu’un échantillon de matière apparaît à nos sens comme continu, même sous les plus forts grossissements des microscopes optiques. Pour répondre à la question posée, la connaissance du nombre N, dit « nombre d’Avogadro », est fondamentale. Le nom d’Avogadro* est associé au nombre N en reconnaissance pour l’hypothèse géniale avancée en 1811 par ce physicien. Dans les mêmes conditions de température et de pression, des volumes égaux de tous les gaz renferment le même nombre de molécules. Cette hypothèse, bien que reprise et appuyée par Ampère, n’eut, pendant un demi-siècle environ, aucun succès auprès des chimistes ; ceux-ci ne comprirent pas qu’elle permettait, par l’établissement d’une distinction fondamentale entre atome et molécule d’un corps simple, de lever les difficultés que la théorie atomique de Dalton rencontrait dans l’interprétation des lois volumétriques de Gay-Lussac*. C’est seulement en 1860 que Cannizzaro réussit à faire adopter ces vues ; une fois comprise, l’hypothèse d’Avogadro fut d’une grande utilité pour l’établissement de la notation chimique. Remarquons que, si l’on prend arbitrairement 16 pour poids atomique de l’oxygène, 32 est son poids moléculaire, puisque la molécule d’oxygène est diatomique ; or, une masse de 32 g d’oxygène gazeux occupe, à 0 °C et sous 1 atmosphère, un volume de 22,4 litres (très sensiblement) ; l’expérience montre que ce même volume est occupé, dans les mêmes conditions, par 28 g d’azote ou par 2 g d’hydrogène, ou encore par 71 g de chlore, dont les molécules sont également diatomiques, ou par 40 g d’argon, dont la molécule est monoatomique, etc. Si l’on applique à ces observations l’hypothèse d’Avogadro, il en résulte immédiatement que les poids atomiques de l’azote, de l’hydrogène, du chlore et de l’argon sont respectivement 14, 1, 35,5 et 40 ; ce sont des poids proportionnels aux poids réels des atomes de ces corps ; le coefficient de proportionnalité commun à tous est par exemple le nombre d’atomes d’oxygène présents dans 16 g de ce corps ou encore le nombre de molécules d’oxygène présentes dans 32 g, c’est-à-dire dans ce qu’on appelle une mole (ou molécule-gramme) d’oxygène. Ce nombre est le nombre d’Avogadro.
Cette notion une fois comprise, le problème s’est posé de la détermination du nombre d’Avogadro. Il s’agit en somme de peser un atome (ou une molécule) d’un corps, oxygène par exemple ; cela n’est pas possible directement, mais, par contre, il suffit de mesurer une propriété pour laquelle chaque atome (ou chaque molécule) intervient par sa masse et de façon connue. De telles propriétés sont nombreuses et appartiennent à des domaines variés. Citons : les phénomènes d’électrolyse ; les phénomènes de transport dans la théorie cinétique des gaz, par exemple, leur viscosité qui concerne le transport de la quantité de mouvement des molécules ; le mouvement brownien, dont l’étude suggéra à Jean Perrin* que certaines propriétés des particules microscopiques en suspension dans un fluide étaient les mêmes que celles qui étaient assignées aux molécules d’un gaz par la théorie cinétique. Cette constatation amena ce physicien à étudier l’équilibre de sédimentation de grains de gomme-gutte, sphériques, de diamètre uniforme et d’ailleurs très petit, en suspension dans un liquide. La théorie cinétique appliquée à cet équilibre, en considérant les grains de gomme-gutte comme des molécules géantes, montre qu’il obéit à la relation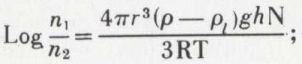
n1 et n2 sont les nombres de particules dans des volumes égaux du liquide séparés par la hauteur verticale h ; ils peuvent être déterminés par des observations faites à l’aide d’un microscope ; (ρ – ρl)g est le poids volumique apparent de la gomme-gutte dans le liquide de suspension ; r est le rayon des grains. Jean Perrin trouva pour N, par application de cette formule, la valeur 6,5.1023. Les expériences de comptage des grains sont difficiles, et leur précision ne peut être que médiocre ; l’accord satisfaisant de la valeur de N ainsi trouvée avec celles qui sont fournies par d’autres méthodes fut considéré à juste titre comme une preuve de la réalité des molécules ainsi que du bien-fondé de la théorie cinétique des gaz. Citons encore, parmi les méthodes qui ont fourni une valeur de N : l’étude des produits de transformations radioactives ; l’emploi de la formule de lord Rayleigh relative à la diffusion de la lumière par les molécules de l’air atmosphérique ; la diffraction des rayons X par un cristal ; cette dernière méthode, particulièrement précise, a donné à N la valeur, actuellement admise, de 6,0224.1023 pour la mole définie sur la base de12C = 12,000..., N étant donc par exemple le nombre de molécules présentes dans une masse 2.15,999 4 = 31,998 8 g d’oxygène naturel. L’inverse du nombre N fournit la valeur en grammes de l’u.m.a. (unité de masse atomique) 1,660 5.10–24 g ; la masse de l’atome d’un élément est alors obtenue, exprimée en grammes, en multipliant l’u.m.a. par le nombre correspondant à l’élément dans le tableau des « poids atomiques » ; on trouve ainsi, par exemple, que la masse de l’atome d’hydrogène est 1,673 7.10–24 g ; il s’agit là cependant d’une valeur moyenne, à cause de la présence des isotopes* dans l’hydrogène naturel.




