ébullition
(bas latin ebullitio, -onis)

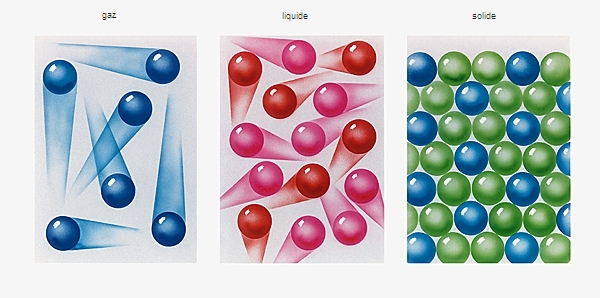
Phénomène qui accompagne le passage de l'état liquide à l'état vapeur (→ gaz) lorsque le processus de vaporisation a lieu à la surface et au sein même du liquide.
PHYSIQUE
Lorsqu'on fournit de la chaleur à un liquide pur dans un milieu où la pression po est constante (c'est ce qui se passe lorsqu'on met une casserole sur le feu), sa température augmente en même temps qu'il s'en évapore une partie → évaporation) ; il se met à bouillir lorsque sa température atteint la valeurTe, où la pression de vapeur saturante Pv(Te) est égale à la pression po.
![Diagramme de phases [4] Diagramme de phases [4]](/encyclopedie/data/images/1003577-Diagramme_de_phases_4.jpg)
Pendant toute la durée de l'ébullition, la température du liquide garde une valeur constante Te : c'est la température d'ébullition à la pression po. La chaleur fournie au liquide pendant l'ébullition, servant uniquement à la vaporisation, est la chaleur latente de vaporisation, déterminée par la relation de Clapeyron (→ fusion).
La pression de vapeur saturante est une fonction croissante de la température (→ transition de phase). La température d'ébullition augmente donc lorsque la pression extérieure croît et ceci jusqu'à une valeur limite, la température critique, au-delà de laquelle on ne peut plus distinguer l'état liquide de l'état vapeur. Inversement, lorsque la pression diminue, la température d'ébullition s'abaisse et peut atteindre la température du point triple avec apparition de la phase solide.

Dans un autocuiseur, où une soupape maintient la pression au-dessus du liquide supérieure à la pression atmosphérique (po ≈ 1,5 atm), la température d'ébullition de l'eau est d'environ 110 °C. Au sommet de l'Everest, où la pression n'est que de 0,35 atm, l'eau bout à 80 °C.
Lorsqu'on chauffe un liquide, il se produit au sein de celui-ci, à partir de germes (poussières contenues dans le liquide, gaz dissous), des petites bulles de vapeur. Ces bulles ne peuvent grossir que lorsque le liquide atteint la température d'ébullition ; la vaporisation a lieu alors à l'intérieur même du liquide. Dans un liquide extrêmement pur (absence complète de germes), ces bulles ne peuvent se former, et on observe un retard à l'ébullition qui peut atteindre plusieurs degrés. La température d'ébullition des solutions obéit aux lois de l'ébulliométrie ; leur concentration et donc leur température varient au cours de l'ébullition.
On appelle température d'ébullition normale la valeur de la température d'ébullition lorsque la pression extérieure est égale à une atmosphère. Les valeurs des températures d'ébullition normale des corps purs peuvent servir d'étalon de température. Voici, en degrés Celsius, les températures d'ébullition de quelques corps purs.
Températures d'ébullition de quelques corps purs
Températures d'ébullition de quelques corps purs | |
corps | température d'ébullition |
acétone | 56,1 °C |
acétylène | – 83,6 °C |
acide acétique | 118,1 °C |
acide nitrique | 86 °C |
alcool éthylique | 78,5 °C |
alcool méthylique | 64,5 °C |
azote | – 195,8 °C |
benzène | 79,6 °C |
brome | 58,8 °C |
butane | 0,6 °C |
chlore | – 34,1 °C |
eau | 100 °C |
éther | 34,5 °C |
glycérine | 290 °C |
hélium | – 268,9 °C |
hydrogène | – 252,8 °C |
iode | 184 °C |
mercure | 356,9 °C |
néon | – 246 °C |
or | 2 600 °C |
oxygène | – 183 °C |
platine | 4 300 °C |
plomb | 1 740 °C |
propane | – 44,5 °C |
soufre | 444,6 °C |
toluène | 110,5 °C |
zinc | 907 °C |





![Diagramme de phases [4] Diagramme de phases [4]](/encyclopedie/data/vignettes/1003577-Diagramme de phases [4].jpg)

