corps
(latin corpus)
CHIMIE
Un corps simple est constitué de molécules dont tous les atomes correspondent à un même élément : l'oxygène ou dioxygène (O2), l'ozone ou trioxygène (O3), le chlore ou dichlore (Cl2) sont des corps simples ; le cuivre est aussi un corps simple si l'on considère son cristal comme une très grosse molécule.
Un corps composé est fait d'atomes ou d'ions correspondant à deux éléments ou plus : le chlorure de sodium est constitué d'ions Na+ et Cl−, l'eau est un assemblage d'oxygène et d'hydrogène.
La notion d'atome
Le mot atome désigne la plus petite particule matérielle correspondant à un élément. On lui attribue le même nom, le même symbole (H pour l'atome d'hydrogène) et un nombre Z (de même valeur que pour l'élément) qui est égal au nombre de protons existant dans le noyau de cet atome, ainsi qu'au nombre d'électrons attachés au noyau de cet atome (ces deux nombres sont égaux, puisque l'atome est électriquement neutre).
Un atome est en effet constitué d'électrons en rotation autour d'un noyau, lequel comporte un certain nombre de protons et de neutrons attachés les uns aux autres par des forces considérables. Ces forces expliquent l'énergie mise en jeu dans toutes les réactions nucléaires, qu'elles consistent en la scission (« fission ») d'un noyau en plusieurs morceaux ou en la « fusion » de plusieurs noyaux en un seul noyau.
Les niveaux d'énergie
La spectroscopie a montré que l'énergie de l'ensemble noyau + électrons que constitue un atome ne peut pas prendre n'importe quelles valeurs. Il existe des niveaux d'énergie permis et les électrons peuvent passer de l'un à l'autre selon certaines règles (certains sauts sont interdits).
Pour l'atome d'hydrogène, la mécanique quantique donne les niveaux d'énergie E permis à l'unique électron, dépendant d'un nombre (quantique) n entier selon l'expression :
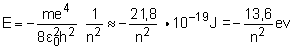
où m est la masse de l'électron, la permittivité du vide, h la constante de Planck, e la charge électrique élémentaire, en prenant pour zéro de l'échelle des énergies l'énergie du système formé d'un proton et d'un électron infiniment éloignés l'un de l'autre, J le symbole du joule et eV le symbole de l'électronvolt.
Pour les autres atomes, on arrive à un résultat similaire, mais qui fait intervenir trois nombres quantiques. Chaque niveau principal, de nombre quantique principal n, est subdivisé en un nombre n de sous-niveaux : on parle généralement de couches et de sous-couches.
Les différentes sous-couches
La première couche, appelée K par les spectroscopistes, ne contient qu'une sous-couche, dite s. La deuxième, la couche L, a deux sous-couches, s et p. La troisième (couche M) contient trois sous-couches, s, p et d. La quatrième (couche N) contient quatre sous-couches, s, p, d et f, et ainsi de suite.
Une sous-couche s contient une case ; une sous-couche p contient 3 cases ; une sous-couche d contient 5 cases ; une sous-couche f contient 7 cases. Toutes les cases d'une même sous-couche, quelle que soit la couche à laquelle elle appartient, permettent de décrire des électrons se situant au même niveau d'énergie.
La symbolique utilisée pour décrire une sous-couche fait état du numéro de la couche (1 pour K, 2 pour L, 3 pour M, etc.) suivi de la lettre désignant la sous-couche (s, p, d…).
Dans l'ordre des niveaux d'énergie croissants, on trouve successivement les sous-couches suivantes:
1s - 2s - 2p - 3s - 3p - 4s - 3d - 4p - 5s - 4d - 5p - 6s - 4f - 5d - 6p - 5f - 6d…
Quand on passe d'un atome au suivant, le cortège électronique du noyau augmente d'une unité : petit à petit les couches électroniques se remplissent, ainsi que les sous-couches, en commençant par celles des niveaux inférieurs. La règle quasi générale veut qu'une sous-couche ne commence à se remplir que lorsque les précédentes sont pleines. Il existe également un principe d'exclusion (Pauli) qui interdit plus de deux électrons dans une case, et une règle (Hund) selon laquelle, dans l'état fondamental, les électrons d'un même niveau d'énergie occupent le plus d'orbitales possible.
Les isotopes
Deux atomes peuvent avoir le même nombre de protons dans leur noyau, donc le même nombre d'électrons autour de ce noyau, et des nombres de neutrons différents : d'après la définition de l'atome, ils correspondent donc au même élément. On dit que ces deux atomes sont isotopes. On connaît plusieurs isotopes pour la plupart des éléments. C'est ainsi qu'à côté du carbone 12 (symbole 12C), qui comporte 6 protons et 6 neutrons dans le noyau, existe l'isotope carbone 14 instable (symbole 14C), qui comporte 6 protons et 8 neutrons dans le noyau.
Deux isotopes différents d'un même élément ont pratiquement les mêmes propriétés chimiques, ce qui se comprend sans difficulté si l'on sait qu'une réaction chimique n'est rien d'autre qu'une modification de l'organisation des électrons autour des atomes constitutifs des substances prenant part à la réaction chimique. Or les arrangements des électrons autour des deux atomes isotopes d'un même élément sont strictement les mêmes. Ils agissent donc de la même façon en présence des mêmes réactifs.
Les gaz nobles, ou gaz rares
Certains corps simples sont monoatomiques. Ils ne s'associent généralement pas avec d'autres atomes. Leur configuration électronique est ns2np6. On les appelle gaz nobles (ils sont gazeux dans les conditions habituelles). C'est en constatant la stabilité de leur configuration qu'on a en fait imaginé la liaison chimique.
Les gaz nobles (ou gaz rares) sont classés dans la colonne 18 du tableau périodique ; ce sont : l'hélium, le néon, l'argon, le krypton, le xénon et le radon. Deuxième élément de la classification, l'hélium est un gaz très peu dense ; un ballon gonflé à l'hélium s'élève dans l'air, sans présenter les dangers d'inflammation ou d'explosion des ballons gonflés à l'hydrogène, car ce gaz ne réagit pas avec l'oxygène.
En raison de leur très grande inertie chimique, les gaz nobles comme l'argon ou le krypton sont utilisés pour le remplissage de lampes à incandescence ; ils ne réagissent pas avec le métal du filament, même quand la température d'utilisation de celui-ci est très élevée.
Malgré la grande stabilité des gaz nobles, on a réussi, depuis 1960, à préparer un certain nombre de composés du krypton et du xénon. Des paires d'électrons de la couche externe peuvent être utilisées par des atomes suffisamment oxydants pour réaliser des liaisons covalentes. Un atome d'oxygène auquel il manque une paire d'électrons peut faire une liaison Xe–O ; on a ainsi préparé l'oxyde XeO3 et l'oxyde XeO4. On connaît aussi des fluorures, des oxyfluorures, des ions XeO64–, HXeO63–, H2XeO62–, etc.
Les métaux et les métaux de transition
Pour les physiciens, les métaux sont des corps simples caractérisés par une grande conductibilité électronique et thermique et par un éclat bien connu. On distingue des métaux vrais et des métaux de transition.
Les métaux vrais
Ce sont par définition des corps simples dont les atomes ont une structure électronique ns1 ou ns2. Ceux de structure ns1 sont appelés métaux alcalins. Ceux qui ont une structure ns2 font partie du deuxième groupe de la classification.
La chimie de ces métaux est simple, comparée à celle des autres éléments de la classification. Les métaux alcalins sont au degré d'oxydation + I et les éléments du deuxième groupe sont au degré + II dans leurs combinaisons.
Quand ils sont à l'état de corps simples, les seules réactions auxquelles ils peuvent participer les conduisent à l'état de cation monovalent M+ pour les premiers, divalent M2+ pour les seconds. Dans ce cas de figure, ces métaux donnent, par exemple, des halogénures ioniques avec les halogènes :
Na(s) + 1/2 Cl2 (g) → NaCl(s).
Très réducteurs, ils s'oxydent facilement. Les réactions opposées qui permettent de les préparer sont difficiles à mettre en œuvre ; par électrolyse des sels fondus, par exemple, procédé qui exige la dépense d'une énergie électrique importante pour imposer à la réaction de se faire dans le sens opposé au sens naturel :
NaCl(l) → Na(l) + 1/2 Cl2(g).
Les sels des métaux vrais sont incolores, sauf s'ils sont en poudre (ils sont alors blancs) et quand l'anion est coloré (permanganate MnO4− violet, chromate CrO4− jaune, par exemple).
Les métaux de transition
Ils correspondent à des éléments des colonnes 3 (IIIA) à 12 (IIB) du tableau périodique. Leur configuration électronique est du type [sous-couches précédentes remplies] (n−1)dx nsy avec :
1 x 10, n = 3, 4, 5, 6, et 0 y 2.
Les métaux de transition ressemblent aux métaux vrais du deuxième groupe : ils ont le même nombre d'électrons ns et une faible électronégativité. Mais, grâce aux électrons d, les électrons disponibles pour former des liaisons sont plus nombreux. Les niveaux électroniques sont souvent très voisins, de sorte que des promotions électroniques sont plus faciles. En conséquence, les états de valence sont nombreux : la chimie des métaux de transition est beaucoup plus variée que celle des métaux vrais. On connaît, par exemple, de nombreux anions oxygénés : des cuprates, des ferrates, des ferrites, des vanadates, des molybdates…
Les ions des métaux de transition sont souvent colorés, contrairement aux cations des métaux vrais : la couleur est due à une absorption dans le visible, à cause de transitions électroniques liées à l'éclatement des niveaux d'énergie des cases d provoqué par l'influence des voisins dans la structure du composé (ce phénomène n'existe pas avec les métaux vrais, car il n'y a pas d'électrons d).
Certains de ces métaux sont peu réactifs : on dit qu'ils sont nobles. Le cuivre, l'argent et l'or, peu ou pas oxydables, sont ou ont été utilisés pour frapper des pièces de monnaie. Le rhodium, l'iridium, le palladium, le platine sont également des métaux nobles.
Certains métaux de transition sont très utilisés. Le cuivre est largement employé pour son excellente conductibilité électrique (appareillage et lignes électriques). Le fer est produit mondialement à plus de 200 millions de tonnes par an, pour de nombreux usages sous forme d'aciers (construction, ouvrages d'art, automobiles, chemins de fer…).
Les éléments p
Les éléments de la colonne 17 : les halogènes
Ce sont les éléments de la colonne 17 (VIIB) du tableau périodique : fluor, chlore, brome, iode et astate (ce dernier étant artificiel et radioactif) ; ils ont 7 électrons sur leur couche de valence, dont la configuration électronique est ns2np5. Ayant un électron de moins que les gaz nobles correspondants qui les suivent (ns2np6), ils acquièrent facilement cet électron manquant.
Les corps simples correspondants, F2, Cl2, Br2, I2, sans parler de l'astate, qui a un moindre intérêt, sont diatomiques : leurs molécules sont purement covalentes, mais l'énergie de la liaison n'est pas très forte (à peu près trois fois moins forte que celle existant dans la molécule H2 pour le fluor, et deux fois moins forte pour les autres), et les corps simples se dissocient plutôt aisément. Leurs atomes acquérant facilement un électron supplémentaire, les halogènes sont de très bons oxydants. Cette propriété trouve une application dans certaines installations de traitement des eaux potables, où le chlore est utilisé pour oxyder, donc pour détruire, les micro-organismes indésirables.
Plus on monte dans la colonne 17, plus l'halogène est oxydant : sa taille, qui se réduit, en fait un élément de plus en plus électronégatif. Le fluor, le plus électronégatif des éléments, ne peut être oxydé par aucune substance chimique. Les autres halogènes sont oxydables et on peut obtenir des anions oxygénés, OCl−, O2Cl−, O3Cl−, O4Cl−, par fixation d'atomes d'oxygène sur les doublets non liants de l'ion chlorure Cl−.
Parmi les ions oxygénés du chlore, il en est un qui mérite une mention particulière, car il est très utilisé comme désherbant : c'est l'ion chlorate, vendu sous forme de chlorate de potassium. Ses qualités très oxydantes en font un désherbant non sélectif qui détruit toute végétation quand il se transforme en chlorure.
Les éléments de la colonne 16
Les élément de la colonne 16 (VIB) du tableau périodique sont l'oxygène, le soufre, le sélénium, le tellure et le polonium ; il ont 6 électrons sur leur couche de valence, dont la configuration électronique est ns2np4 : ils ont 2 électrons de moins que les gaz nobles correspondants. Étant plus éloignés que les halogènes de la configuration des gaz nobles, ils sont moins oxydants. Si l'oxygène et le soufre sont encore de très bons oxydants, ce pouvoir diminue régulièrement quand on descend dans la colonne.
L'oxygène
L'oxygène oxyde pratiquement tout, l'or et les premiers gaz nobles exceptés. On connaît des oxydes de tous les autres éléments, même si on ne peut pas toujours les obtenir par synthèse directe. Ainsi, la synthèse directe des oxydes d'azote à partir des molécules O2 et N2 ne se fait pas : les liaisons dans ces deux molécules sont multiples, et en conséquence très fortes (494 et 946 kJ . mol−1), de sorte que ces deux molécules mises en présence ne réagissent pas.
La réactivité chimique de l'oxygène O2 est dominée par deux faits : d'une part, la molécule est très stable ; d'autre part, l'atome d'oxygène est très électronégatif. L'oxygène moléculaire est donc peu réactif, mais quand la molécule O2 est dissociée, la réaction peut être très violente : ainsi le mélange d'air et de vapeurs d'essence, qui ne réagit pas dans le réservoir d'une voiture, explose-t-il dans les cylindres du moteur, car il y a une dissociation des molécules O2 initiée par l'étincelle produite par les bougies.
L'oxygène complète sa couche de valence soit en prenant deux électrons à un réducteur, ce qui conduit à des ions oxydes O2−, soit en partageant deux électrons avec des espèces moins réductrices, ce qui conduit à des composés covalents (H2O, par exemple).
La plupart des réactions d'oxydation sont lentes : le fer rouille (il y a formation d'oxyde de fer ferrique), et le charbon brûle plutôt lentement ; dans notre organisme, l'oxygène apporté par l'oxyhémoglobine ne participe qu'à des oxydations très peu rapides. Les réactions sont si lentes souvent qu'un catalyseur est nécessaire à leur réalisation.
Le soufre
Le soufre a une configuration externe analogue à celle de l'oxygène, mais il est plus lourd puisqu'il possède 8 électrons de plus. Par ailleurs, une sous-couche d vide existe sur sa couche de valence. De ces remarques, des analogies et des différences avec l'oxygène peuvent être déduites.
Le soufre conduit à des sulfures S2− par capture de deux électrons pris à des réducteurs. La plupart des sulfures des métaux de transition sont insolubles, et, s'ils se sont formés dans des terrains non oxydants, on peut les extraire en qualité de minerais pour obtenir soit du métal, soit du soufre (à l'état de dioxyde SO2), soit l'un et l'autre : citons la galène (PbS), la pyrite (FeS2), la pyrite de cuivre (FeCuS2), la blende (ZnS). En milieu oxydant, les sulfures se transforment en sulfates SO42−, où le soufre est au centre d'un tétraèdre dont les 4 sommets sont occupés par 4 atomes d'oxygène, avec lesquels il forme 4 liaisons covalentes. Cette structure est particulièrement stable : on trouve en conséquence de nombreux dérivés du soufre comportant de tels tétraèdres. Le plus important d'entre eux sur le plan industriel est l'acide sulfurique, dont la production est encore considérée comme indice du développement technologique d'un pays, et ce malgré le développement de la pétroléochimie.
C'est la plus grande dimension de l'atome de soufre qui conduit ce corps simple à réaliser une structure géométrique moléculaire très différente de celle de l'oxygène O2 : les atomes ne peuvent s'approcher suffisamment pour réaliser des liaisons multiples stables. On a en conséquence des liaisons simples en chaînes, qui peuvent être linéaires ou cycliques. L'une des variétés allotropiques du soufre est faite de cycles à 8 atomes de soufre, 4 dans un plan, 4 dans un autre. Une autre variété allotropique du soufre est constituée de chaînes d'atomes de soufre, plus ou moins longues. Dans les deux cas, chaque atome de soufre est lié à 2 atomes voisins et comporte deux doublets électroniques non liants. Ce n'est qu'à relativement haute température que chaîne ou cycle se rompent et qu'on obtient des molécules diatomiques S2 de structure analogue à celle de O2.
Les éléments de la colonne 15
Les éléments de la colonne 15 (VB) du tableau périodique sont l'azote, le phosphore, l'arsenic, l'antimoine et le bismuth ; ils ont 5 électrons sur leur couche de valence, dont la configuration électronique est ns2np3 : il leur manque 3 électrons pour avoir la structure stable des gaz nobles qui les suivent. Pour compléter cette couche, ces éléments ont surtout tendance à contracter des liaisons covalentes : l'ammoniac NH3, la phosphine PH3 sont des molécules pyramidales.
L'azote
La molécule d'azote N2 possède une triple liaison entre les deux atomes, d'une très grande énergie, ce qui confère à N2 une très grande stabilité.
L'ammoniac est l'intermédiaire industriel de l'azote moléculaire N2 à l'acide nitrique, produit en gros tonnages pour les besoins de l'industrie des engrais, et pour la production des explosifs classiques et de nombreux dérivés nitrés.
Les engrais azotés sont classés en trois groupes : les engrais nitriques, qui contiennent l'ion nitrate NO3−, les engrais ammoniacaux, qui comportent l'ion ammonium NH4+, et les engrais ammoniaco-nitriques, qui renferment ces deux ions, parmi lesquels les ammonitrates, mélanges de nitrate d'ammonium et d'argile, sont les plus employés.
Le phosphore
L'atome de phosphore est plus gros que celui d'azote ; en conséquence, la triple liaison qu'on pourrait imaginer entre deux atomes pour faire une molécule P2 n'est pas assez forte, et le phosphore choisit d'autres structures moléculaires. Une variété allotropique est faite de molécules P4 tétraédriques, où chaque atome est lié aux trois autres.
La chimie du phosphore est donc beaucoup plus riche que celle de l'azote, malgré une configuration électronique externe identique : il dispose de cases 3d, vides à l'état fondamental mais susceptibles d'être utilisées pour contracter des liaisons supplémentaires. Le fait qu'il soit plus gros que l'azote permet par exemple de faire des ions PO43−, tétraédriques, alors que l'ion NO43− est impossible à réaliser (il ne peut exister plus de 3 atomes d'oxygène autour d'un atome d'azote).
Le potassium
Le potassium entre dans la composition d'engrais dits potassiques, qui contiennent l'ion K+, sous forme de chlorure ou de sulfate de potassium, et dans la composition d'engrais phosphatés, à base de phosphates naturels plus ou moins transformés.
Parmi ceux-ci figurent les superphosphates, dont les différentes qualités sont obtenues en traitant le phosphate naturel par un acide, comme l'acide sulfurique, suivant l'équation chimique simplifiée :
Ca3(PO4)2 + 2 H2SO4 = Ca(H2PO4)2 + 2 CaSO4.
Le mélange qui en résulte constitue le superphosphate simple.
Les autres corps simples de la famille ont des réactivités analogues à celle du phosphore, mais on observe une évolution non négligeable vers un caractère métallique quand le numéro atomique croît. Le bismuth, par exemple, est attaqué par l'acide nitrique concentré et chaud, pour donner du nitrate de bismuth (ion Bi3+).
Les éléments de la colonne 14
Les éléments de la colonne 14 (IVB) du tableau périodique sont : le carbone, le silicium, le germanium, l'étain et le plomb ; ils ont 4 électrons sur leur couche de valence, de configuration ns2np2. Il leur faut donc trouver 4 électrons pour la saturer. Le diamant (variété allotropique du carbone), le silicium, le germanium et l'étain gris (variété allotropique de l'étain) cristallisent sous forme d'une succession de tétraèdres où chaque atome est lié à 4 atomes par covalence. Cette liaison assure une grande cohérence à l'édifice cristallin, ce qui explique la dureté exceptionnelle du diamant : capable de rayer n'importe quelle substance, il est utilisé industriellement pour réaliser des outils de coupe. Aucun électron n'étant libre dans une telle structure, le cristal est un isolant électrique (ce qui n'est pas le cas de l'autre forme allotropique du carbone, le graphite).
Le silicium
On sait purifier le silicium jusqu'à obtenir des taux d'impureté ne dépassant pas 10−7 %, ce qui permet de l'utiliser dans l'industrie électronique. Cette substance peut devenir meilleure conductrice quand on introduit dans ses cristaux des atomes du groupe 15 ou du groupe 13 (on parle alors de dopage) : si l'on introduit un atome du groupe 15, de phosphore par exemple, un électron supplémentaire, qui ne peut trouver place dans l'ensemble des cases p (bande p) du silicium, se loge obligatoirement dans la bande supérieure vide, où il est libre de circuler à son aise. Il en résulte une conductibilité non négligeable, par suite du déplacement de charges négatives (semi-conducteur n). Si l'on introduit un atome du groupe 13, de gallium par exemple, il manque 1 électron par atome de ce métal rare, et des lacunes électroniques (trous positifs) apparaissent dans la bande p du silicium (semi-conducteur p).
Le germanium
Le germanium présente le même comportement et sa résistance spécifique à la température ordinaire est élevée. Si on le chauffe, on excite un certain nombre d'électrons, qui passent d'une bande pleine (où les mouvements d'électrons sont impossibles) à une bande vide, dite bande de conduction, en sautant une étroite bande interdite : la résistance chute donc. On dit que le germanium est un semi-conducteur intrinsèque. On obtient par dopage, comme avec le silicium, une semi-conductibilité extrinsèque, de type n avec des atomes de la colonne 15, et de type p avec des atomes de la colonne 13. Silicium et germanium sont à la base de nombreux composants électroniques.
L'étain
L'étain présente trois variétés allotropiques : au-dessous de 13,2 °C, la structure (α) est celle du diamant ; entre 13,2 °C et 161 °C, elle est quadratique centrée (β) ; au-delà, la structure est rhomboédrique. La structure intermédiaire β est celle qu'on connaît couramment (vaisselle en étain) : cet étain β est malléable. L'étain α est cassant du fait de sa structure.
Le plomb
Le plomb n'a qu'une variété allotropique (cubique à faces centrées), caractéristique des métaux. On constate d'ailleurs une tendance de plus en plus marquée au caractère métallique au fur et à mesure qu'on descend dans la colonne 14 : si le carbone n'est pas du tout métallique, et le silicium pratiquement pas, l'étain et le plomb ont un caractère métallique marqué (ils sont par exemple assez réducteurs pour réduire H+ en H2, dans des conditions toutefois particulières).
Les éléments de la colonne 13
L'aluminium
Les éléments de la colonne 13 (IIIB) du tableau périodique sont : le bore, l'aluminium, le gallium, l'indium et le thallium. Le plus important d'entre eux est l'aluminium, dont la couche de valence a pour configuration électronique 3s23p1. Il peut être oxydé à l'état d'ion Al3+, ce qui indique sa nature métallique ; mais il peut aussi compléter sa couche de valence en donnant des ions aluminates, anions oxygénés de l'aluminium où les atomes d'oxygène apportent des doublets électroniques qui lui manquent : la soude attaque l'aluminium, ce qui ne se produirait pas avec un vrai métal. L'aluminium, qui a selon les circonstances un comportement métallique ou un comportement non métallique, est donc, chimiquement parlant, un semi-métal.
Cependant, sur le plan physique, on peut dire que le corps simple aluminium est un métal : il en a l'éclat, l'excellente conductibilité électrique et thermique ; sa structure cristalline (cubique à faces centrées) est également caractéristique d'un métal. Il fond à relativement basse température (660 °C).
L'aluminium est largement présent dans la lithosphère (7,45 %), mais le seul minéral utilisé pour l'extraire est la bauxite. Celle-ci, traitée par de la soude sous pression (procédé Bayer), donne un aluminate de sodium soluble et des insolubles. La solution est filtrée, et on fait précipiter le trihydrate d'alumine qu'elle contient. Ce dernier, chauffé à 1 200 °C, se transforme en alumine, qui est alors électrolysée ; l'utilisation d'un fondant (cryolithe Na3AlF6) permet de diminuer sa température de fusion. L'aluminium est recueilli à la cathode.




