alcyne
(de alc[ool] et suffixe -yne)
Hydrocarbure dérivant des alcanes, contenant une triple liaison C≡C et de formule générale CnH2n−2. [Synonyme : hydrocarbure acétylénique.]
1. Nomenclature des alcynes
Les alcynes, de formule générale CnH2n–2 (où n est le nombre d’atomes de carbone dans la molécule), se caractérisent par la présence d’une triple liaison dans la molécule. Ils sont également appelés hydrocarbures acétyléniques, en référence au nom d’usage du premier terme de la série, l’acétylène (ou éthyne dans la nomenclature officielle de l’IUPAC) → alcane, alcène, hydrocarbure.
Selon qu’il existe un ou deux groupes alkyles, on classe les alcynes en deux groupes :
• les alcynes monosubstitués (ou vrais) de formule R–C≡C–H ;
• les alcynes disubstitués de formule R–C≡C–R′ (les radicaux R et R′ pouvant être identiques ou différents).
2. Propriétés physiques des alcynes
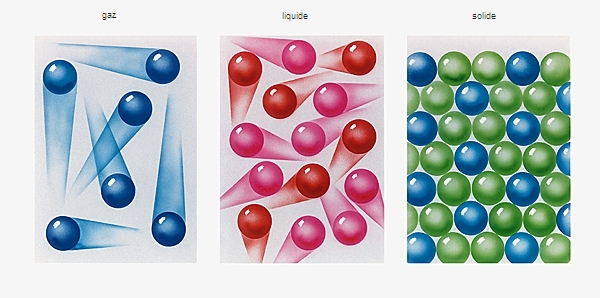
Dans les conditions normales de température et de pression, les trois premiers termes des alcynes (acétylène [C2H2], propyne [C3H4 ] et but-1-yne [C4H6]) sont gazeux. Les termes suivants sont liquides, puis solides, à mesure que leur masse moléculaire augmente.
Contrairement aux alcènes, les alcynes présentent des points d’ébullition supérieurs à ceux des alcanes ayant le même nombre d’atomes de carbone.
3. Réactivité des alcynes
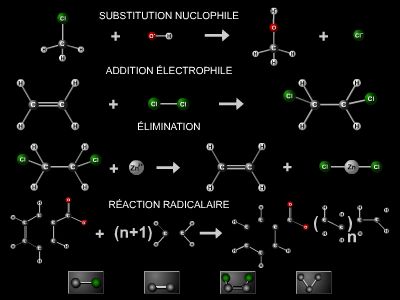
Comme les alcènes, les alcynes réagissent par addition électrophile (→ réaction chimique), mais la présence de la triple liaison fait que la réaction s’accomplit en deux temps : il y a d’abord une formation intermédiaire de composés à double liaison éthylénique, puis ceux-ci subissent une nouvelle addition.
Par exemple, l’addition de HCl sur la triple liaison d’un alcyne conduit, en deux étapes successives, tout d’abord à une double liaison, puis à une liaison simple saturée, HCl s’additionnant toujours selon la règle de Markovnikov :
R–C≡CH
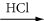 R–CCl=CH2
R–CCl=CH2
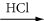 R–CCl2–CH3
R–CCl2–CH3
Avec l’eau, en présence de sels de mercure, l’acétylène conduit à de l’acétaldéhyde :
HC≡CH + H2O → CH2=CHOH → CH3–CHO
Les autres alcynes vrais forment des cétones: il y a ainsi une régiosélectivité de la réaction. Le propyne, par exemple, conduit à la propanone :
CH3C≡CH + H2O → CH3COCH3
Les alcynes vrais ont un caractère acide : l’atome d’hydrogène est remplaçable par un métal (formation d’alcynures métalliques du type RC≡C−Na+).
Les alcynes, du fait de leur grande réactivité, donnent des réactions de polymérisation. Tel est surtout le cas avec l’acétylène ; selon les conditions opératoires, il se forme du vinylacétylène (H2C≅CH―C≡CH), du divinylacétylène (CH2=CHC≡CCH=CH2), ou encore des composés cycliques (benzène C6H6 ou cycloocta-1,3,5,7-tétraène C8H8).
Par ailleurs, la triple liaison des alcynes peut également subir une oxydation en présence d’oxydants énergiques (acide chromique par exemple), conduisant à une coupure de la molécule avec formation de deux acides :
R–C≡C–R′ → R–COOH + R′ –COOH
4. État naturel et préparations des alcynes
Les alcynes sont extrêmement rares dans la nature (l’acétylène existe à l’état de trace dans l’atmosphère). On les prépare artificiellement en laboratoire selon deux voies principales :
• l’alkylation de l’acétylène ou d’un alcyne vrai : cette méthode consiste à remplacer un atome d’hydrogène (ou les deux dans le cas de l’acétylène) par un groupement alkyle, par l’intermédiaire de dérivés métalliques ; elle s’effectue ainsi suivant les deux étapes suivantes :
R–C≡C–H → R–C≡C–M → R–C≡C– R′
• la création d’une triple liaison dans une chaîne carbonée saturée : cette méthode consiste à « supprimer » des atomes d’hydrogène et d’halogènes d’un dérivé dihalogéné (double déshydrohalogénation) ; elle nécessite des conditions opératoires très « énergiques », par exemple la déshydrobromation du dibromo-1,1-propane s’effectue en solution concentrée de soude, à chaud :
CH3–CH2–CHBr2 + 2 OH− → CH3–C≡CH + 2 Br− + 2 H2O
5. Utilisations des alcynes
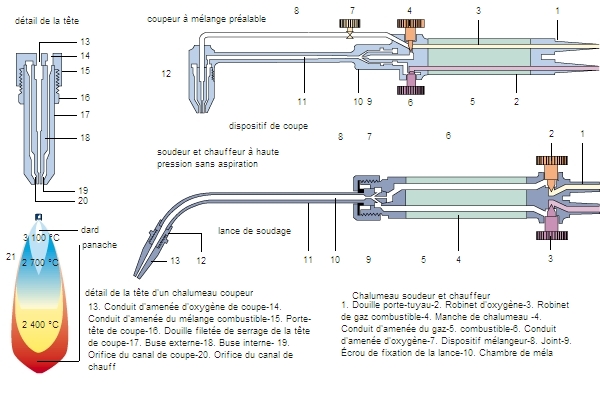
Les alcynes sont essentiellement des produits de laboratoire. Le seul alcyne présentant un intérêt industriel est l’acétylène (C2H2), qui sert de matière de base à de nombreuses synthèses. Cependant, il est de plus en plus remplacé par l’éthylène, dont la préparation demande moins d'énergie et est plus économique.
Toutefois l’acétylène reste utilisé pour sa puissance calorifique dans le chalumeau oxyacétylénique, qui permet de réaliser la soudure et le découpage de tôles, même sous l’eau.