acide sulfurique
(latin sulfur, soufre)

Acide oxygéné H2SO4 dérivé du soufre, corrosif violent.
CHIMIE
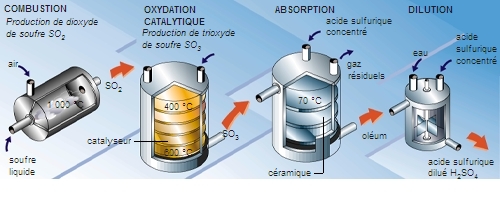
L'anhydride sulfurique SO3 se présente en cristaux transparents fondant à 17 °C et bouillant à 45 °C. Il est très avide d'eau, avec laquelle il donne de l'acide sulfurique. On le prépare dans l'industrie par oxydation catalytique du gaz sulfureux, en vue de le transformer en oléum.
L'acide sulfurique H2SO4 a été produit industriellement dès 1746 ; sa fabrication par le procédé des chambres de plomb se développa surtout à partir de 1837, et le procédé de contact fut découvert par Winkler en 1901.
Propriétés
L'acide pur est un liquide épais, incolore, qui se solidifie à 10 °C et bout à 290 °C en se dissociant et en formant un mélange azéotrope, bouillant à 320 °C, qui contient environ 98 % d'acide pur. C'est ce mélange qui constitue l'acide concentré du commerce ; de densité 1,84, il marque 66 °B. Il est soluble dans l'eau, avec un grand dégagement de chaleur ; aussi faut-il, pour éviter des projections dangereuses, verser toujours l'acide dans l'eau. Cette affinité pour l'eau le fait employer à la dessiccation des gaz.
L'acide sulfurique peut dissoudre de l'anhydride SO3 et donner des liquides huileux, nommés oléums, qui laissent souvent déposer des cristaux d'acide pyrosulfurique ou disulfurique H2S2O7. Décomposé à haute température en gaz sulfureux, oxygène et eau, il peut être réduit par le carbone, le soufre et le cuivre. C'est un diacide fort donnant avec la soude un hydrogénosulfate NaHSO4 et un sulfate Na2SO4. Il agit sur la plupart des sels et attaque à froid les métaux, donnant un dégagement d'hydrogène. Sur les glucides, il agit comme déshydratant ; sur les bases organiques et les alcools, il agit en acide ; avec les carbures benzéniques et leurs dérivés, il produit des réactions de sulfonation.
Préparation
Dans le procédé des chambres de plomb, ou procédé aux oxydes d'azote, le gaz sulfureux est oxydé par l'air, en présence d'eau, avec catalyse par les oxydes de l'azote :
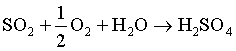
Le mélange gazeux est envoyé d'abord dans la tour de Glover, en haut de laquelle ruisselle un acide sulfurique contenant des produits nitreux et provenant de la tour de Gay-Lussac. L'acide s'y concentre, les gaz se refroidissent et s'emparent des oxydes de l'azote, qu'ils entraînent. Ces gaz passent ensuite dans de vastes chambres en feuilles de plomb, dans lesquelles on envoie aussi de l'eau chaude pulvérisée et où se forme et se condense un acide dilué. L'anhydride sulfureux est ainsi entièrement transformé. Les oxydes de l'azote sont récupérés pour être recyclés dans la tour de Glover. Avec le procédé aux oxydes, on ne peut obtenir d'acide dépassant la concentration du mélange azéotropique.
Le procédé de contact permet la préparation d'acides plus concentrés, les oléums, par oxydation de l'anhydride sulfureux en phase gazeuse à température modérée (400 à 450 °C), en présence d'un catalyseur, l'anhydride vanadique. Les vapeurs d'anhydride sulfurique produites sont absorbées par de l'acide sulfurique à 66 °B, qu'elles transforment en oléums.
Utilisations
L'acide sulfurique est un produit industriel fondamental. Il sert à préparer la plupart des autres acides (chlorhydrique, nitrique, etc.), de nombreux sulfates et les superphosphates, de multiples produits organiques nécessaires à la fabrication des colorants, des plastiques, des explosifs, des parfums, des médicaments, des fibres artificielles. Il est aussi utilisé pour le raffinage des essences, la fabrication du glucose et le décapage des métaux.





