chaleur
(latin calor, -oris)

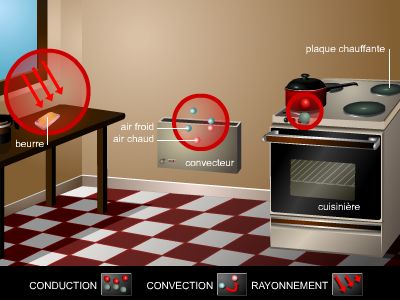
Mode de transfert de l'énergie d'un corps à un autre qui ne correspond pas à un travail. (L'énergie ainsi transférée se nomme quantité de chaleur.)
PHYSIQUE
Les phénomènes de dilatation dus à la chaleur furent employés dès 1612 à la mesure des températures. À la fin du xviiie s., on pensa que la chaleur était transmise par un fluide impondérable, le calorique. C'est avec Lavoisier et Laplace que s'établit la distinction entre température et quantité de chaleur et qu'avec la définition de la calorie (1838), prit naissance la calorimétrie. On reconnut ensuite que les changements d'état sont valables pour tous les corps et que la chaleur rayonnante est de même nature que la lumière. En 1824, Sadi Carnot énonça les relations qui existent entre la chaleur et le travail, jetant ainsi les bases de la « thermodynamique ». Le caractère statistique de cette science sera mis en évidence (Maxwell, Boltzmann, Planck) à la fin du xixe s.
THERMODYNAMIQUE
Un apport de chaleur provoque le plus souvent une variation de la température du système qui le reçoit (→ capacité calorifique), mais il peut aussi provoquer une transition de phase (fusion, vaporisation, allotropie) à température constante (→ chaleur latente). Le concept de quantité de chaleur contenue dans un corps n'a pas de sens ; on ne peut parler que de la quantité de chaleur reçue au cours d'une transformation. Les échanges de chaleur et de travail d'un système avec l'extérieur sont régis par les deux premiers principes de la thermodynamique. La théorie cinétique de la matière assimile le transfert de chaleur entre deux systèmes à un transfert de l'énergie cinétique des atomes ou molécules qui les constituent. L'unité de quantité de chaleur du système SI est le joule. On utilise encore fréquemment la calorie et l'unité anglo-saxonne BTU (surtout pour les combustibles).
Le point de fusion est la température à laquelle un corps pur commence à passer de l'état solide à l'état liquide et qu'il conserve tant que la fusion n'est pas terminée. Lorsqu'on fournit à pression constante de la chaleur à un solide pur, sa température s'élève, puis, au point de fusion, reste constante tandis que du liquide apparaît ; lorsque tout le corps est fondu, la température s'élève à nouveau. Pendant la fusion, la chaleur fournie au corps sert à la transition de phase ; c'est la chaleur latente de fusion. Le volume de la plupart des corps augmente lors de la fusion, mais ce n'est pas le cas de l'eau, par exemple.




