macromolécule (suite)
On distingue, suivant l’enchaînement des motifs, plusieurs types de macroions ou macromolécules :
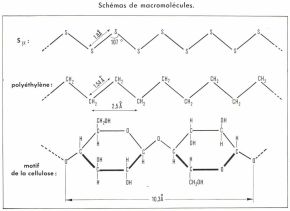
a) linéaires (ou filiformes, caténiformes, unidimensionnels), où l’enchaînement des motifs est comparable à celui des maillons d’une chaîne ordinaire ; exemples : soufre mou Sn, polyéthylène, fibroïne de la soie, cellulose, Nylon, polychlorure de vinyle, asbeste (amiante) ; ces ions et molécules sont flexibles, et certains peuvent, assemblés, constituer des fils souples et résistants, à propriétés textiles ;
b) lamellaires (ou bidimensionnels), dont l’exemple type est le graphite, dans lequel les atomes de carbone sont ordonnés, dans des plans parallèles, suivant les nœuds d’un pavage hexagonal régulier : l’ensemble des atomes dans un plan constitue une macromolécule bidimensionnelle ; le talc, les micas, les argiles sont formés de macroions lamellaires. Le caractère essentiel est l’indépendance relative des plans, qui peut entraîner le clivage facile, ou l’onctuosité au toucher et les propriétés lubrifiantes ;
c) tridimensionnels, dont le diamant, la silice cristallisée ou non, les zéolites (silicoaluminates), les phénoplastes et aminoplastes sont des exemples ; la rigidité résulte de la présence de liens covalents dans plusieurs directions. Remarquons que l’on peut accroître la rigidité d’une substance macromoléculaire en créant de nouvelles liaisons entre ses macromolécules ; exemple : pontage au soufre du polyisoprène (vulcanisation du caoutchouc).
De nombreux macroions et macromolécules peuvent être mis en solutions ; celles-ci cependant n’obéissent pas de façon satisfaisante aux lois tirées de la thermodynamique classique, en particulier aux lois de Raoult ; cela est dû aux grandes différences de masse et de dimension entre les macromolécules du soluté et la molécule du solvant, eau par exemple ; on a dû, pour établir une théorie de ces solutions, faire intervenir des raisonnements de thermodynamique statistique. Les solutions macromoléculaires présentent de façon générale les caractères des solutions colloïdales (v. colloïde) de viscosité élevée.
Les propriétés chimiques des macromolécules sont en principe celles du motif qui les constitue ; de plus, la dégradation par la chaleur ou par des agents chimiques peut intervenir, en particulier pour les macromolécules organiques, qui se brisent en donnant naissance à des molécules ordinaires dont la partie essentielle est le motif de la macromolécule ; c’est ainsi que la cellulose ou l’amidon, soumis à l’hydrolyse acide, fournissent finalement du glucose, et que les nombreux protéides des organismes vivants donnent naissance à des aminoacides.
R. D.
Quelques savants
Giulio Natta,
chimiste italien (Imperia 1903). Depuis 1952, grâce à l’emploi des catalyseurs stéréospécifiques qu’il avait découverts, il s’est attaché à la production de hauts polymères à structure géométrique régulière, et ce résultat a été mis à profit pour la fabrication de matières plastiques de haute qualité. Prix Nobel de chimie en 1963.
Hermann Staudinger,
chimiste allemand (Worms 1881 - Fribourg-en-Brisgau 1965). Il a été le premier à reconnaître l’existence de macromolécules, à déterminer leurs structures, à étudier leurs propriétés et à examiner leurs possibilités de synthèse. Prix Nobel de chimie en 1953.
Karl Waldemar Ziegler,
chimiste allemand (Helsa, près de Kassel, 1898 - Mülheim 1973). Il a mis au point un procédé de fabrication à basse pression des polyéthylènes à structure rectiligne. Prix Nobel de chimie en 1963.
P. Piganiol, Macromolécules, t. I : Physique et structure des plastiques (Dunod, 1947). / J. Duclaux, Macromolécules et matières plastiques (P. U. F., 1949). / G. Champetier, Chimie macromoléculaire (A. Colin, 1957 ; nouv. éd., 1971). / J. Néel, Exposés de chimie macromoléculaire (Gauthier-Villars, 1966). / G. Champetier et L. Monnerie, Introduction à la chimie macromoléculaire (Masson, 1969).