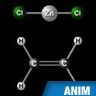
réaction chimique

Transformation se produisant lorsque plusieurs espèces chimiques sont mises en présence, ou lorsqu'une seule espèce chimique reçoit un apport extérieur d'énergie, et se traduisant par l'apparition d'espèces chimiques nouvelles.
CHIMIE
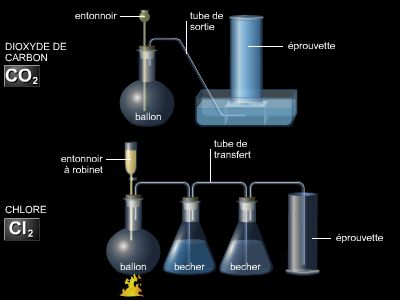
Opération fondamentale par laquelle on crée de nouvelles substances, la réaction chimique consiste en une transformation de la matière. Au cours de celle-ci, les atomes des molécules des réactifs se séparent puis se réarrangent pour donner naissance à de nouvelles molécules, qui constituent les produits de la réaction. Avant de tenter une réaction, il faut se demander si les réactifs mis en présence vont réagir pour donner les produits espérés. La plupart des réactions chimiques se déroulent en effet dans un sens privilégié. Dans certains cas, c'est l'inverse de la réaction souhaitée qui tend à se produire ! La solution de ce problème nécessite le recours à la thermodynamique chimique.
Lorsqu'une réaction est « possible » – elle tend alors à se dérouler spontanément dans une direction donnée –, il importe d'en connaître la vitesse. Cela conditionne le passage du laboratoire à l'unité de production industrielle, qui se doit de fonctionner sans à-coups et sans réactions intempestives ; ce passage implique la réalisation d'installations « pilotes » de plus en plus grosses permettant d'optimiser les conditions de la réaction.
Les mécanismes de réaction
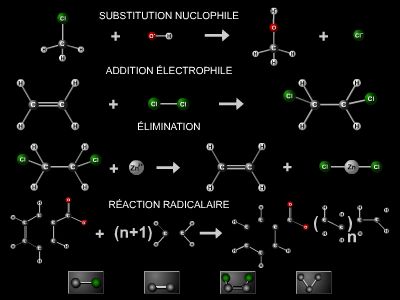
Une réaction chimique s'accompagne de réarrangements dans la position des atomes ainsi que de modifications des diverses liaisons interatomiques. La façon dont ces changements se produisent au cours du temps constitue le mécanisme de réaction (ou mécanisme réactionnel). Celui-ci se déduit d'études sur la cinétique.
Très souvent, une réaction chimique peut être décomposée en réactions plus simples, dites réactions élémentaires. Par exemple, l'oxydation de HI (iodure d'hydrogène) par H2O2 (eau oxygénée) s'effectue en deux étapes :
HI + H2O2 → HOI + H2O (1) et HOI + HI → I2 + H2O (2)
soit, au total : 2HI + H2O2 → I2 + 2H2O.
Dans ce schéma, l'espèce HOI qui est créée dans la réaction (1) mais consommée dans la réaction (2) est un intermédiaire réactionnel. Sa durée de vie peut être très brève, mais elle est, en principe, mesurable. Cet intermédiaire peut être observé par des techniques spectroscopiques.
Si l'on considère maintenant une réaction élémentaire (réaction se déroulant en une seule étape), on peut préciser la synchronisation entre les mouvements des différents atomes. L'exemple le plus simple est celui d'une réaction de substitution au cours de laquelle il se produit un mouvement concerté des atomes. Ceux-ci passent par une configuration géométrique instable, appelée complexe activé, qui n'est réalisée que pendant une durée de l'ordre de la période d'une vibration moléculaire (10−13 s).
L'écriture des réactions chimiques
Réactions quantitatives
Depuis l'introduction, en 1815, par le baron Jöns Jacob Berzelius, de la représentation des éléments chimiques par des symboles auxquels sont associées des masses atomiques, on décrit les réactions chimiques par des équations chimiques, où apparaissent les formules des espèces chimiques initiales et finales.
Ces équations apportent toutefois beaucoup plus d'informations que la simple indication qualitative des espèces qui réagissent et de celles qui sont formées à l'issue de la réaction : la connaissance des masses atomiques (qui ont été établies avec une grande précision, à l'exception de celles des éléments radioactifs) permet de déterminer, de façon quantitative, les masses de réactifs qu'il faut mettre en présence pour obtenir les produits de la réaction sans qu'il reste de produits initiaux si celle-ci est complète.
Ainsi, en faisant réagir de l'aluminium (Al) et du soufre (S), on obtient du sulfure d'aluminium (Al2S3), suivant la réaction : 2Al + 3S → Al2S3. Les coefficients placés devant les symboles chimiques (appelés coefficients stœchiométriques) représentent les nombres de moles de chaque réactif qu'il faut mettre en présence pour que la réaction soit complète. Deux moles d'aluminium (de masse molaire M = 27 g), soit 54 g, mélangées à trois moles de soufre (M = 32 g), soit 96 g, donnent ainsi une mole de Al2S3 (M = 2 × 27 + 3 × 32 = 150 g). La réaction est complète tant que la proportion 54/96 est respectée. On exprime, par cet exemple, la loi de la conservation de la masse de Lavoisier, suivant laquelle la masse des substances formées est égale à celle des substances initiales.
Cela signifie, en particulier, qu'une équation chimique doit toujours faire apparaître autant de fois le symbole d'un élément dans sa partie gauche (réactifs initiaux) que dans sa partie droite (substances formées).
Dans le cas où des gaz interviennent, comme dans la réaction d’oxydation complète du fer par le dioxygène : 3 Fe + 2O2 → Fe3O4, il est plus utile d'utiliser le volume molaire (le même pour tous les gaz), qui vaut 22,4 l à 0 °C. Ainsi, 3 moles de fer (M = 56 g), soit 168 g, réagissent avec 2 moles d'oxygène, soit 44,8 l, pour donner une mole d'oxyde de fer (M = 3 × 56 + 4 × 16), soit 232 g de Fe3O4.
Réactions complètes ou limitées
Les équations chimiques permettent également d'indiquer si les réactions qu'elles représentent sont complètes ou limitées. Lorsque la réaction est complète, elle s'exprime dans l'équation par une flèche orientée de gauche à droite (→) située entre les formules des réactifs initiaux et celles des substances formées.
Lorsqu'une réaction est limitée, elle conduit à un équilibre chimique, et cela s'exprime par deux flèches de sens opposés (⇄) dans l'écriture de l'équation : on indique ainsi que, dans les conditions expérimentales (pression, température) dans lesquelles se produit la réaction, les espèces chimiques mentionnées à gauche réagissent partiellement entre elles pour former les substances mentionnées à droite, mais que, dans les mêmes conditions, les espèces chimiques de droite peuvent réagir partiellement entre elles pour former les espèces de gauche.
Tel est le cas de l'acide acétique et de l'éthanol, qui, lorsqu'on les met en présence, en proportion équimolaire, aussi longtemps qu'on veut à la température ordinaire, ne réagissent qu'en partie en formant de l'acétate d'éthyle et de l'eau :
CH3―COOH + CH3―CH2―OH ⇄ CH3―COO―CH2―CH3 + H2O.
Dans les mêmes conditions, si l'on met en présence de l'acétate d'éthyle et de l'eau en proportion équimolaire, ils se transforment partiellement en acide acétique et en éthanol, et l'état d'équilibre obtenu est identique dans les deux cas.
Catalyse et vitesse de réaction
Certaines réactions n'ont lieu qu'en présence de substances bien précises, appelées catalyseurs, qui aident les produits à se former, mais n'entrent pas dans la composition des produits en réaction. Au sein d'une cellule, par exemple, les réactions biochimiques sont en général catalysées par des protéines particulières appelées enzymes, et l'on compte pratiquement autant d'enzymes qu'il y a de réactions chimiques. En isolant, en 1833, l'amylase, une enzyme pouvant scinder l'amidon, Anselme Payen et Jean-François Persoz ont démontré toute l'importance de ces catalyseurs (qu'ils appelaient à l'époque des diastases) : ils permettent en effet d'extraire l'énergie contenue dans les longues chaînes carbonées, par exemple les aliments chez l'homme. Ainsi la lipase aide à digérer les graisses en les découpant en éléments plus simples appelés acides gras, la lactase décompose le lactose, ou sucre du lait, en sucres assimilables (glucose et galactose). → catalyse
La vitesse de réaction chimique est un facteur déterminant : elle dépend notamment de la température et de la concentration des réactifs en présence. Une réaction pourra se produire instantanément tandis qu'une autre nécessitera un temps très long. Par exemple, l'oxydation du fer à l'air libre, la rouille, peut durer des jours, voire des années si l'air est sec. En revanche, une explosion de nitroglycérine est la manifestation d'une réaction chimique extrêmement rapide qui libère une grande quantité de gaz en un temps très court : d'où la destruction provoquée par l'onde de choc de l'explosion.
Voir également : électrolyse, oxydoréduction.
BIOCHIMIE
Les phénomènes d'oxydation au niveau des cellules ont une grande importance parmi les phénomènes vitaux. Qu'elles soient attribuées à une fixation directe de l'oxygène (Warburg) par la catalyse des oxydases ou à une déshydratation sous l'influence des déshydrases (Thunberg et Wieland), les oxydations cellulaires sont le résultat d'actions enzymatiques qui aboutissent finalement à la production d'énergie et à l'élimination des déchets toxiques.