immunologie (suite)
En raison de cette grande complexité, l’analyse structurale n’a pu progresser que grâce à l’étude de populations homogènes d’immunoglobulines comme celles qui sont produites au cours de la maladie de Kahler et de la maladie de Waldenström. On connaît actuellement cinq classes d’immunoglobulines : les IgG, les IgA, les IgM, les IgD et les IgE, par ordre de concentration sérique décroissante (les IgG sont au taux de 12 mg/ml dans le sérum, les IgE au taux de 0,000 3 mg/ml).
Les immunoglobulines G (IgG), qui représentent 75 p. 100 des immunoglobulines, sont donc les mieux connues.
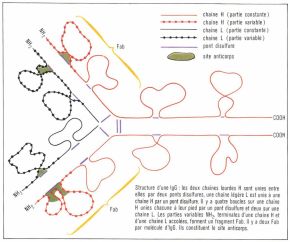
Elles sont composées de deux chaînes légères identiques L (light, léger), de poids moléculaire 23 000, et de deux chaînes lourdes H (heavy, lourd) deux fois plus longues et plus lourdes que les précédentes.
Ces chaînes sont formées par des acides* aminés formant entre eux des liaisons peptidiques entre le groupement acide de l’un et le groupement aminé de l’autre ; le nombre des acides aminés d’une chaîne lourde est donc deux fois plus grand que celui d’une chaîne légère. L’étude de la séquence de ces acides aminés constitue un travail très long ; elle a été cependant réalisée pour un certain nombre de chaînes L depuis 1965 et pour quelques chaînes H récemment.
Chaque chaîne légère peut être divisée en deux parties : une moitié carboxy-terminale, formée de 107 acides aminés dont la structure primaire est identique pour toutes les chaînes légères (région constante), et une moitié amino-terminale (107 acides aminés) variable d’une molécule d’anticorps à une autre. De même, une chaîne lourde formée de 440 acides aminés est composée d’une partie constante, constituant les trois quarts carboxy-terminaux, et d’une partie variable constituant le quart amino-terminal. Les chaînes lourdes et légères sont reliées entre elles par des ponts disulfures, et il existe plusieurs boucles à l’intérieur des chaînes H et L.
De l’étude de cette structure, on peut déduire l’origine de la spécificité de l’anticorps ; elle est déterminée par la région hautement variable de l’immunoglobuline située au niveau du fragment, appelé « Fab », qui résulte de l’association de la partie variable d’une chaîne légère. Certains acides aminés de cette région, notamment au niveau de la boucle, entrent en contact étroit avec les acides aminés mi les sucres constitutifs du site antigénique. Le site anticorps sert ainsi, en quelque sorte, de réceptacle au site antigénique. La spécificité est assurée par la variation des acides aminés qui entrent en jeu et aussi par le repliement dans l’espace des diverses parties de la chaîne. On déduit également de cette structure qu’une molécule d’anticorps IgG peut se combiner à deux sites antigéniques, car il y a deux fragments Fab par molécule : on dit que l’anticorps est bivalent. Les IgA, les IgD et les IgE ont une structure à peu près identique. L’IgM, par contre, est beaucoup plus volumineuse (masse de 900 000 et est constituée de cinq sous-unités ayant une structure de base du même type que l’IgG.
La synthèse cellulaire des anticorps
L’introduction d’un antigène convenable dans un organisme entraîne la production par cet organisme d’anticorps spécifiques, qui, comme toutes les molécules, sont synthétisés par des cellules.
Pour mettre en évidence le lieu de cette synthèse, on peut utiliser un antigène fluorescent qui se fixe sur l’anticorps à l’intérieur même de la cellule où il est synthétisé. Les cellules sont aisément reconnaissables par leur cytoplasme fluorescent lorsqu’on les observe avec un microscope à lumière ultraviolette. Les anticorps sont ainsi produits par des cellules spécialisées, localisées dans les tissus lymphoïdes, et notamment la rate et les ganglions lymphatiques, et qui sont essentiellement les plasmocytes. Il semble qu’en général un plasmocyte ne synthétise qu’un seul anticorps, de classe et de type fixes. Au cours de la maladie de Kahler, il se produit une prolifération maligne d’un clone (ensemble des cellules descendant d’une même cellule) cellulaire qui aboutit à la synthèse en quantité énorme de molécules d’immunoglobuline toutes identiques.
La réaction antigène-anticorps
Le fait essentiel est la spécificité très étroite de cette réaction, dont on a vu le mécanisme ; on avait d’ailleurs comparé l’antigène à une clef qui ne peut ouvrir qu’une seule serrure, l’anticorps. Cette spécificité n’est toutefois pas absolue, et l’on peut obtenir une réaction entre un haptène A et un anticorps dirigé contre un haptène B si l’haptène B est très peu différent de A. L’étude de la nature des interactions chimiques et physiques mises en jeu dans cette réaction spécifique et réversible fait actuellement l’objet de travaux de recherche.
Les conséquences de la réaction antigène-anticorps
La plus anciennement connue est la réaction de précipitation. On met dans un tube une solution de l’antigène en présence de l’anticorps correspondant. Pour un certain rapport entre les quantités d’antigène et les quantités d’anticorps introduites, il se forme un précipité insoluble. Pour l’expliquer, certains chercheurs attribuent un rôle prépondérant à la charge électrique et au caractère hydrophile des macromolécules en solution, d’autres font ressortir le rôle de la formation de pontages entre les anticorps bivalents et les antigènes (théorie du réseau).
Les réactions de précipitation sont très utilisées en pratique. On préfère cependant actuellement placer les anticorps et les antigènes non pas en milieu liquide, mais en milieu gélifié (gélose, agarose). Le principe est identique : l’anticorps et l’antigène, placés en deux endroits distincts du gel, diffusent l’un vers l’autre et précipitent lorsqu’ils se rencontrent au rapport d’équivalence. La réaction peut être pratiquée en tube (méthode d’Oudin) ou sur plaque (méthode d’Ouchterlőny). Ces méthodes permettent notamment de rechercher un antigène dans une solution ; ainsi, en médecine, on recherche l’alpha-I-fœto-protéine dans le sérum d’un malade suspect d’être porteur d’un cancer primitif du foie en mettant en présence le sérum et un anticorps anti-alpha-I-fœto-protéine dans deux réservoirs creusés dans le gel. Si dans le sérum il existe, parmi toutes les autres molécules, cette protéine, on observe un trait de précipitation. De même, dans le diagnostic d’une hépatite infectieuse, on met en présence le sérum du malade susceptible de contenir l’antigène Australia et un antisérum anti-Australia.
Si l’on met un mélange d’anticorps en présence d’un mélange des antigènes correspondants, on obtient plusieurs traits séparés, que l’on peut identifier.




