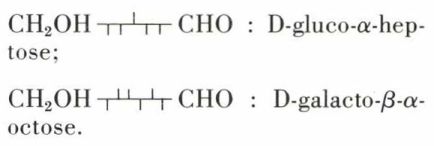glucides (suite)
À la formule (I) correspondent 16 diastéréoisomères ; deux d’entre eux, le mannose et le galactose, furent assez rapidement extraits de substances végétales et, dès lors, le problème de la configuration stérique des aldohexoses était posé. Il fut résolu grâce à des méthodes de dégradation renouvelables qui font passer d’un aldose à son homologue inférieur :
Chaque dégradation fait disparaître un carbone asymétrique, mais ne modifie pas la configuration stérique des carbones groupés.
Dégradé ainsi trois fois, le glucose est transformé en l’aldotriose
CH2OH—CHOH—CHO
(aldéhyde glycérique). On aboutit ainsi à la forme dextrogyre de cet aldéhyde, que l’on a appelée, pour cette raison, aldéhyde D-glycérique, et écrit arbitrairement :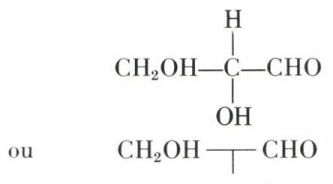
(configuration absolue démontrée par la suite).
Tout aldose dont la dégradation jusqu’en C3 conduit à l’aldéhyde D-glycérique est dit appartenir à la série D ; s’il conduit au contraire à l’aldéhyde lévogyre (L-glycérique), il est dit appartenir à la série L. C’est pour cette raison, et non parce qu’il est dextrogyre sous ses formes α et β, que nous désignerons dorénavant le glucose par D-glucose.
Tout aldose est oxydable (HNO3) en un diacide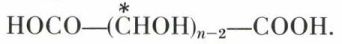
Celui-ci peut être symétrique ou dissymétrique, c’est-à-dire inactif ou actif sur la lumière polarisée (pour les projections conventionnelles ci-dessous, v. stéréochimie).
Dégradé deux fois, le D-glucose est transformé en D-érythrose, dont l’oxydation conduit à l’acide mésotartrique inactif : le D-érythrose s’écrit donc :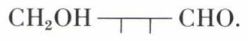
Mais une seule dégradation du D-glucose conduit au D-arabinose, oxydable en un diacide actif : le D-arabinose est
Il reste, pour le D-glucose, l’alternative entre les deux formules :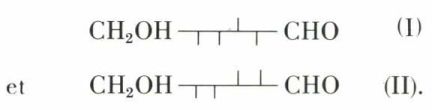
Parmi les 16 aldohexoses, un seul, le D-mannose, est oxydable en acide D-mannosaccharique, alors que deux aldohexoses, le D-glucose et le L-gulose (synthétique), s’oxydent en un même diacide, l’acide D-saccharique ; il s’ensuit que le D-glucose a la formule (I), car le L-gulose, qui peut être écrit indifféremment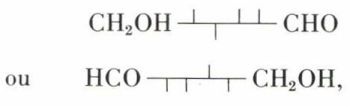
est différent du D-glucose, mais s’oxyde en le même diacide.
Telles sont les conclusions d’un admirable travail d’Emil Fischer (1880-1890), conclusions depuis lors incontestées.
Les formes cycliques du D-glucose sont respectivement :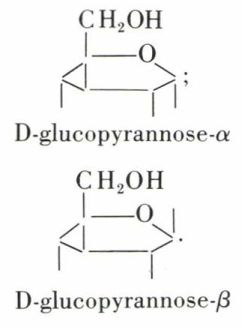
Les plus communs, parmi les autres aldohexoses, sont ainsi représentés :
Les 13 autres diastéréoisomères sont connus, mais beaucoup résultent de synthèses partielles, dont voici deux exemples :
a) Le D-galactose est oxydé en acide D-galactonique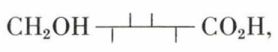
que les solutions alcalines isomérisent réversiblement en acide D-talonique
Après séparation, le second est réduit en D-talose
b) Le D-glucose est oxydé par l’eau de brome en acide D-saccharique
Une réduction ménagée de ce dernier régénère, en faible partie, le D-glucose, mais, en majorité, son diastéréoisomère, le L-gulose,
Parmi les réactions des aldoses normaux, il convient de citer l’action de la phénylhydrazine en excès. Le D-glucose conduit ainsi à la D-glucosazone, bien cristallisée,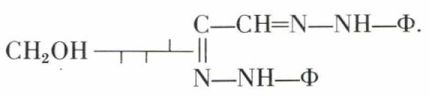
Mais le D-mannose engendre la même osazone, ce qui permet, immédiatement, de déduire la configuration stérique du D-mannose et celle du D-glucose.
Cétohexoses
Les 8 diastéréoisomères que la théorie prévoit sont connus ; leur configuration stérique se déduit de celle des aldohexoses. En effet, le lévulose, ou D-fructose, conduit à la même osazone que le D-glucose ou le D-mannose ; sa configuration est donc :
Fortement lévogyre sous ses formes α et β, provenant d’une cyclisation hexagonale et donnant lieu à mutarotation, il appartient néanmoins à la série D (α et β D-fructopyrannoses).
Le D-fructose est présent dans le miel ; il apparaît, avec le D-glucose, dans l’hydrolyse du saccharose, ou, seul, dans celle de l’inuline (polyoside du Topinambour). Il est fortement sucré et assimilable.
Comme les aldoses, les cétoses sont réducteurs (liqueur de Fehling et nitrate d’argent ammoniacal) ; mais l’oxydation rompt la molécule ; tous les oses sont donc réducteurs.
Tous brunissent sous l’action des alcalis concentrés.
Les aldohexoses naturels, de la série D, le D-fructose sont fermentescibles et subissent, en particulier, la fermentation alcoolique :
C6H12O6 → 2 CO2 + 2 C2H5OH.
Les autres hexoses peuvent subir d’autres fermentations.
Les trioses, les cétotétroses ne peuvent se cycliser ; ils n’existent que sous une forme et ne présentent pas la mutarotation. L’aldéhyde glycérique, possédant une fonction aldéhyde libre, rougit le réactif de Schiff, ce que ne font pas les aldoses supérieurs. Les aldotétroses et les cétopentoses sont cyclisés, sous formes α et β, mais le cycle est pentagonal (furannose). Libres, tous les autres oses sont cyclisés en pyrannoses, mais, dans les holosides, ils interviennent parfois sous forme furannose (cf. saccharose).
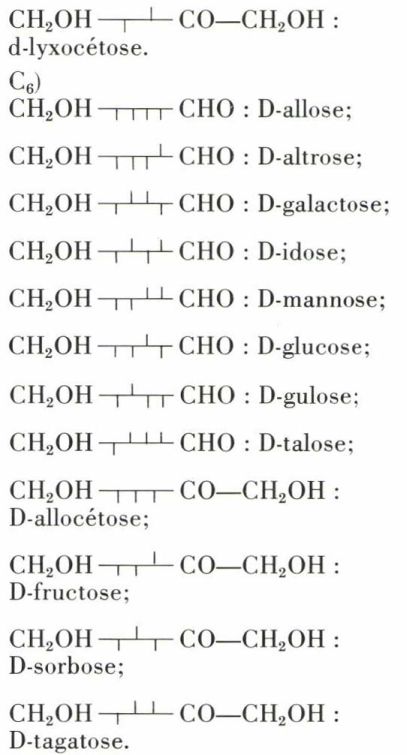
Voici les noms et les formules stériques des oses de la série D jusqu’en C6. Les formules stériques des oses de la série L s’en déduisent par une symétrie.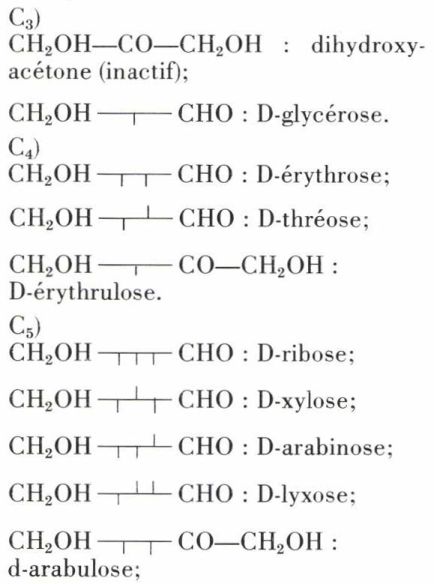
Les oses supérieurs ont reçu une nomenclature systématique qui les rattache aux aldohexoses et que deux exemples vont illustrer :