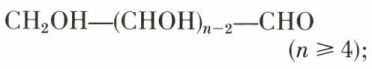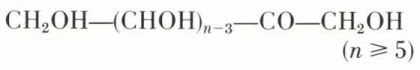Nombreuse famille de composés naturels, autrefois appelés sucres, qui jouent un rôle fondamental dans la nutrition et dans le métabolisme.
La plupart sont d’origine végétale, mais quelques-uns sont présents dans les organismes animaux. D’autre part, si la nature fournit un grand nombre de diastéréoisomères, tous ne s’y rencontrent pas, et la synthèse, partielle ou totale, a permis de compléter les séries lacunaires.
Les glucides se divisent en trois catégories principales.
Les oses, qui seront définis ci-dessous, ne peuvent subir une scission hydrolytique.
Les holosides, au contraire, s’hydrolysent en plusieurs oses identiques ou différents ; on appelle polyosides ceux qui présentent le caractère de macromolécules.
L’hydrolyse des hétérosides fournit, à côté d’un ou de plusieurs oses, des molécules qui ne sont plus des oses et que l’on nomme aglycones.
Les oses et holosides simples sont des composés cristallisés, très solubles dans l’eau et ne connaissant pas, pratiquement, d’autre bon solvant. Leur saveur est plus ou moins sucrée.
Les polyosides ne sont solubles, au sens vulgaire du mot, dans aucun solvant, mais certains forment des solutions aqueuses colloïdales ; ils sont dépourvus de saveur.
Les hétérosides ont des propriétés physiques et organoleptiques très variables en fonction de la nature de l’aglycone ; leur saveur est amère ou sucrée ; on trouve parmi eux des colorants (anthocyanes), des astringents (tannins), des poisons, employés à faible dose comme médicaments (digitaloside), et des agents fondamentaux de la biosynthèse (acide désoxyribonucléique).
Oses
Les oses normaux se divisent en deux classes :
les aldoses
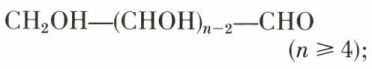
les cétoses
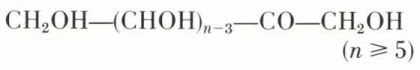
[avec les restrictions à apporter à ces formules linéaires].
Les oses aberrants se distinguent des précédents soit par une chaîne trop courte (n < 4 pour les aldoses, n < 5 pour les cétoses), soit par une place différente du carbonyle dans la chaîne, ou bien par une ramification de celle-ci, ou encore, surtout, par l’absence d’une ou de plusieurs fonctions alcool (désoxyoses). Seuls, ces derniers ont une importance comparable à celle des oses normaux.
Structure des oses
Cette étude sera surtout consacrée au plus connu des oses, le glucose. Ce sucre forme les efflorescences à la surface des fruits secs (raisin, figue). C’est un solide fondant vers 150 °C, très soluble dans l’eau et moyennement sucré.
Le produit commercial résulte de l’hydrolyse acide de l’amidon.
Bien purifié et recristallisé lentement dans l’eau, il apparaît sous forme hydratée (C6H12O6, H2O), laquelle fond à 80 °C, perd son eau sous vide et recristallise anhydre pour fondre à 146 °C ; c’est le glucose-α. Si, au contraire, on ajoute un excès d’alcool à une solution aqueuse saturée, il se dépose une autre variété cristalline, fondant à 150 °C ; c’est le glucose-β.
Une solution aqueuse fraîche de glucose-α a un pouvoir rotatoire spécifique de + 113° ; une solution fraîche de glucose-β a un pouvoir rotatoire de + 19°, mais le pouvoir rotatoire des deux solutions évolue en 24 heures vers la même limite : + 52°. Le phénomène, valable pour tous les oses normaux, s’appelle mutarotation ; il s’explique par une transformation lente et équilibrée des solutions.
Les glucoses-α et -β anhydres ont pour formule C6H12O6 ; l’hydrogénation catalytique conduit au sorbitol C6H14O6, que l’acide iodhydrique, en tube scellé vers 200 °C, réduit en hexane normal,
CH3—(CH2)4—CH3.
On en conclut que la chaîne carbonée est linéaire. De plus, le sorbitol peut être estérifié 6 fois par l’anhydride acétique. C’est donc l’un des 10 diastéréoisomères
CH2OH—(CHOH)4—CH2OH.
Il était alors naturel de considérer le glucose comme un produit de déshydrogénation partielle du sorbitol (aldéhyde ou cétone 5 fois alcool). Or, l’oxydation du glucose par l’eau de brome conduit à un acide en C6, et l’action de l’hydroxylamine transforme le glucose en une oxime déshydratable en nitrile ; il s’agit donc d’une fonction aldéhyde, et tout cela est en parfait accord avec la formule plane :

Mais le glucose peut être méthylé 5 fois (CH3I en milieu alcalin).
Si la formule (I) était exacte, le dérivé pentaméthylé serait :

donc aldéhydique et réducteur ; or il ne l’est pas.
On a donc supposé que la fonction aldéhyde de la formule (I) s’était hémiacétalysée avec la fonction alcool en δ, d’où la formule cyclique :
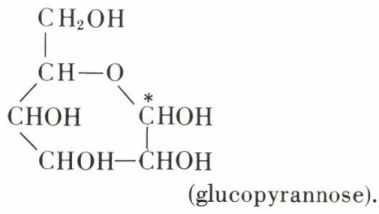
Cette cyclisation fait apparaître, en plus des 4 carbones asymétriques de la formule I, un 5e carbone asymétrique (*) ; celui-ci peut prendre deux configurations, d’où l’existence possible de deux formes cristallisées (glucoses-α et -β).
En solution aqueuse, ces deux formes s’équilibrent par passage transitoire par la forme aldéhydique I, qui participe si peu à l’équilibre qu’elle est indécelable par les critères physiques (U. V., Raman). Mais, cette forme étant détruite par les réactifs de la fonction aldéhyde, l’équilibre est déplacé en sa faveur, de sorte que les solutions présentent les propriétés des aldéhydes ; de fait, les solutions de glucose réduisent la liqueur de Fehling (dosage) et le nitrate d’argent ammoniacal (argenture).
Cette hypothèse est corroborée par le fait que les glucoses-α et -β conduisent à des dérivés pentaméthylés différents (II),
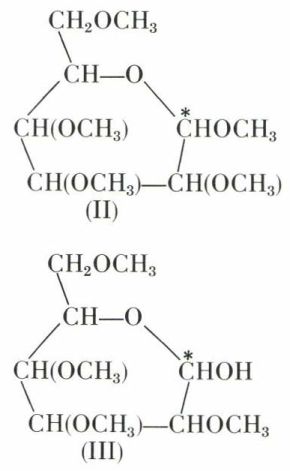
non réducteurs et ne présentant plus la mutarotation, car la fonction aldéhyde est bloquée.
En milieu faiblement acide, seule la fonction acétal est hydrolysée, d’où le glucose tétraméthylé (III), qui redevient réducteur et subit la mutarotation ; la formule pyrannose est donc pleinement satisfaisante.