élément chimique
Principe chimique commun aux diverses variétés d’un même corps simple, ainsi qu’aux combinaisons de ce corps simple avec d’autres corps : le phosphore blanc, le phosphore violet, le phosphore noir... sont autant de variétés, d’aspects et de propriétés divers, d’un même corps simple ; une qualité cependant leur est commune, celle d’être constitués d’un même élément, l’élément phosphore ; celui-ci est également commun à toutes les combinaisons phosphorées, quelle que soient leur provenance ou leur préparation.
Généralités
Le concept d’élément est fondé sur l’expérience. L’analyse immédiate résout les mélanges en corps purs, dont on extrait un petit nombre de corps simples, indécomposables mais fournissant par réactions chimiques mutuelles l’ensemble très vaste des composés actuellement connus ; c’est du corps simple, produit d’expérience, qu’est issue la notion d’élément. Il n’en fut pas toujours ainsi ; parmi les théories chimiques de l’Antiquité, celle qui reçut l’approbation d’Aristote* affirmait l’existence de quatre éléments : l’eau, le feu, la terre et l’air, mais ceux-ci représentaient plutôt des qualités, des états de la matière que la matière elle-même. L’alchimie adopta le concept d’Aristote, et c’est seulement au xviie s. que Boyle*, rejetant ces notions infécondes et sans fondement scientifique, posa pour l’élément la définition de corps indécomposable, différent d’un mélange ou d’une combinaison. À partir de là s’est poursuivie, de Lavoisier* jusqu’à nos jours, l’identification des 100 et quelques éléments que nous connaissons.
La théorie atomique a permis de donner un support à la notion assez abstraite d’élément chimique : l’élément, c’est l’atome, considéré dans ce qu’il a de proprement chimique, c’est-à-dire caractérisé par l’ensemble de ses électrons, donc par son numéro atomique et sa formule électronique. Si, par contre, des atomes de même formule électronique diffèrent entre eux par le nombre de neutrons du noyau, ce seront, pour le chimiste, des isotopes d’un même élément, car l’incidence, à charge égale, de la composition du noyau sur les propriétés chimiques de l’atome est ordinairement négligeable.
Suivant les règles de la notation chimique, à chaque élément correspond un symbole, formé d’une ou deux lettres, et un poids atomique, rapport du poids de N atomes du mélange naturel des isotopes de cet élément au poids d’un nombre égal d’atomes de l’isotope  de l’élément carbone ; on trouvera à l’article notation chimique une table alphabétique des éléments, des symboles et des poids atomiques relatifs à
de l’élément carbone ; on trouvera à l’article notation chimique une table alphabétique des éléments, des symboles et des poids atomiques relatifs à 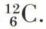
Classification des éléments
La constatation d’analogies conduisit, dès le début du xixe s., à considérer quelques triades d’éléments. Puis J.-B. Dumas* (1830) classa les non-métaux en familles naturelles, et Jacques Thenard (1777-1857) classa de même les métaux d’après leur oxydabilité ; mais l’idée de périodicité n’apparut qu’avec Chancourtois puis Newlands, le premier proposant une classification « hélicoïdale », le second sa « loi des octaves », tous les deux sans succès. En 1869, cependant, Lothar Meyer fit remarquer la curieuse courbe en dents de scie que l’on obtient quand on porte en ordonnée le volume de l’atome-gramme des éléments à l’état solide, et en abscisse leur poids atomique (sur la figure, on a porté le numéro atomique, qui varie dans le même sens) ; la même année, D. I. Mendeleïev* proposait sa classification naturelle périodique : les quelque 60 éléments alors connus y étaient disposés, par poids atomiques croissants, suivant un certain nombre de rangées et de groupes, de façon que ne figurent dans le même groupe que des éléments analogues par leurs propriétés et par les formules de leurs composés oxygénés et hydrogénés ; pour y parvenir, Mendeleïev avait dû laisser des cases vides, affirmant que des éléments restaient à découvrir, dont il n’hésita pas à prévoir les propriétés. Les découvertes ultérieures du gallium, du scandium, du germanium et de bien d’autres, confirmant les prévisions de Mendeleïev, contribuèrent au succès de sa classification.
La classification actuelle dérive de celle de Mendeleïev, mais les éléments y sont rangés non par poids atomiques, mais par numéros atomiques croissants ; ainsi se trouvent éliminées les inversions (Co, Ni ; Te, I...) qu’avait dû faire Mendeleïev pour respecter les analogies à l’intérieur des groupes. Sous sa forme longue, la plus claire, elle comporte 18 groupes et 7 périodes très inégales, chacune de ces périodes se terminant avec un gaz inerte ; l’inégalité des périodes vient d’une part du fait que les couches successives d’électrons — K, L, M... — contiennent des niveaux en nombre croissant, et d’autre part de ce qu’il y a, à partir de la 4e période, chevauchement de divers niveaux (v. atome). Cette classification fait d’abord ressortir les analogies verticales entre éléments d’un même groupe : le groupe I A, par exemple, est celui des métaux alcalins ; le groupe VII B, celui des halogènes, etc. ; mais elle fait également ressortir des analogies horizontales dans la partie médiane du tableau, où se trouve, du scandium au zinc, une première série d’éléments dits « de transition » ainsi que deux autres immédiatement au-dessous ; ces séries, de 10 éléments, correspondent au remplissage « différé » d’un niveau (n – 1)d, alors que le niveau ns est déjà en place, entraînant l’analogie chimique. Quelque chose d’analogue se rencontre avec les éléments des terres rares, dont la séparation chimique, principalement réalisée par Georges Urbain (1872-1938), fut très difficile, ce qui montre de profondes analogies ; mais là, pour ne pas allonger démesurément le tableau, on est convenu de loger tous ces éléments dans la case du lanthane, leur chef de file. La fin du tableau comporte des séries incomplètes d’éléments, tous radio-actifs ; ceux qui sont au-delà de l’uranium sont artificiels, les derniers obtenus étant en quantités infimes et difficiles à classer. L’existence à l’état naturel du technétium (43Tc), du prométhium (61Pm) et de l’astate (85At) n’a pu être reconnue de façon certaine ; ce sont des éléments artificiels, produits de fission ou de bombardement nucléaire, et radio-actifs.




