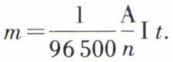électrolyse (suite)
La théorie ionique permet d’interpréter qualitativement et quantitativement le phénomène d’électrolyse ; la molécule d’un électrolyte est formée d’ions* : ions positifs, ou cations, et ions négatifs, ou anions. Le cation est généralement formé de l’atome d’un métal ayant perdu un ou plusieurs électrons, suivant sa valence : on a ainsi les ions Na+, Ca++, Fe+++, etc. ; les acides donnent l’ion H+ ; il existe également des cations complexes formés d’un groupement d’atomes comme NH4+. L’anion est parfois l’atome d’un métalloïde ayant gagné un électron, comme Cl–, mais, le plus souvent, c’est un ion complexe : NO3–, SO4– –, PO4– – –, etc.
Dans un cristal ou dans un gaz, les ions sont étroitement associés par les forces électriques qui s’exercent entre les ions de signes contraires, mais, en solution dans un solvant ionisant ou fondu, ces forces sont beaucoup plus faibles, de sorte que les ions peuvent se déplacer les uns par rapport aux autres. Sous l’action d’un champ électrique, les cations se déplacent vers la cathode, dans le sens du champ, alors que les anions vont vers l’anode, en sens inverse. De plus, en solution, il y a souvent solvatation des ions, c’est-à-dire que ceux-ci fixent des molécules de solvant qui se déplacent avec eux : par exemple, l’ion H+ peut fixer une molécule d’eau pour former l’ion OH3+.
Au sein du bain électrolytique, les ions gardent leur individualité, mais lorsqu’ils arrivent au contact des électrodes, ils se déchargent : il se produit alors des réactions chimiques engendrant des corps nouveaux, produits de l’électrolyse qui n’apparaissent qu’au voisinage des électrodes. Ces réactions chimiques sont très variées et souvent très complexes, mais on peut dire en règle générale que, puisque l’anode reçoit des électrons, il s’y passe une oxydation, alors qu’il se passe une réduction près de la cathode, qui fournit des électrons.
Le principe de conservation de l’électricité et celui de la non-accumulation des charges en régime stationnaire impliquent que l’intensité du courant soit la même à l’anode et à la cathode ; par conséquent, le nombre d’électrons fournis à l’anode est égal à celui des électrons cédés par la cathode. Ces électrons cédés par la cathode au milieu électrolytique lui arrivent par le fil conducteur la reliant au pôle négatif du générateur ; les électrons libérés à l’anode repartent vers le pôle positif de ce générateur.
Sir Anthony Carlisle
Chirurgien anglais (Stillington 1768 - Londres 1840). Il étudia les effets physiologiques des piles et découvrit en 1800, avec le chimiste William Nicholson (Londres 1753 - id. 1815), l’électrolyse en décomposant l’eau par le courant.
Réduction cathodique
En général, on obtient à la cathode un dépôt de métal ou un dégagement d’hydrogène, ce qui correspond à la libération de l’élément le moins électropositif existant dans le bain. Ainsi, l’électrolyse d’une solution de sel de cuivre fournit à la cathode un dépôt de cuivre, alors que, pour une solution de sel de sodium, on obtient un dégagement d’hydrogène.
Oxydation anodique
On distingue deux modes très différents d’oxydation anodique : le premier correspond à l’anode soluble, qui est une anode métallique dont le métal passe en solution sous forme d’ion. C’est notamment le cas lorsque le métal de l’anode est celui du sel électrolyse : anode de cuivre dans une solution de sulfate de cuivre ; anode d’argent dans une solution de nitrate d’argent. Le métal cède des électrons en passant à l’état d’ion. Dans le deuxième mode, l’anode est inattaquable, ou passive, et on obtient soit un dégagement d’oxygène ou d’un halogène, soit une réaction assez complexe.
Exemples d’électrolyse
Bien souvent, il n’y a aucun rapport entre les ions qui assurent le passage du courant et les produits qui se forment sur les électrodes. Ainsi, si l’on place en série deux électrolyseurs qui contiennent l’un une solution de soude, l’autre une solution d’acide sulfurique, on recueille les mêmes volumes d’oxygène aux anodes et d’hydrogène aux cathodes ; dans la première, le courant est transporté par les ions Na+ et OH– ; dans la seconde, par les ions H+ et SO4– –. Les réactions qui se passent aux électrodes sont, dans le cas de l’électrolyse de la solution de soude avec une anode passive en fer ou en nickel :
— à l’anode, un dégagement d’oxygène aux dépens des ions OH–,
4 OH– → O2 + 2 H2O + 4e– ;
— à la cathode, l’hydrogène dégagé se forme aux dépens de l’eau,
4 H2O + 4e– → 2 H2 + 4 OH–.
Les gaz dégagés proviennent de la décomposition de l’eau, puisque les ions OH– sont régénérés. La soude, dont la masse reste constante, tend à se concentrer autour de la cathode.
Dans l’électrolyse de la solution d’acide sulfurique avec des électrodes de platine, l’oxygène dégagé à l’anode se forme aux dépens de l’eau :
2 H2O → O2 + 4 H+ + 4e–.
À la cathode, il y a dégagement d’hydrogène ;
4 H+ + 4e– → 2 H2.
Dans ce cas aussi, les gaz dégagés proviennent de la décomposition de l’eau, et la masse totale d’acide reste constante, mais sa concentration augmente au voisinage de l’anode.
Solution de sulfate de cuivre avec des électrodes de cuivre : les ions qui conduisent le courant sont Cu++ et SO4– –. L’anode est soluble :
Cu → Cu++ + 2e–.
Du cuivre se dépose sur la cathode :
Cu++ + 2e– → Cu.
Il y a transport de cuivre de l’anode à la cathode.
Loi quantitative de Faraday*
Cette loi concerne le cas où un corps simple est libéré à une électrode, le plus souvent la cathode. La masse du corps simple libéré est proportionnelle à la quantité d’électricité q qui a traversé l’électrolyseur, c’est-à-dire, si le courant est constant, au produit de l’intensité I par la durée t de l’électrolyse ; elle est en outre proportionnelle à la masse atomique A de l’élément et inversement proportionnelle à la valence n de l’ion, c’est-à-dire proportionnelle à l’équivalent électrochimique A/n. La formule correspondante est :