eau (suite)
Propriétés chimiques
Par suite du dipôle électrique associé à la molécule d’eau et par suite de ses possibilités de liaison hydrogène, l’eau donne des composés d’addition avec un grand nombre de sels.
Les diverses molécules d’eau peuvent parfois se trouver associées de façons différentes (par exemple, le composé FeSO4, 7 H2O peut encore s’écrire [Fe(H2O)6] SO4, H2O ; c’est le sulfate de fer II à 7 molécules d’eau ou. de façon plus précise, le sulfate d’hexaquofer II à une molécule d’eau ; ce que précise l’étude structurale, en particulier par l’utilisation de la diffraction des rayons X).
On observe aussi des réactions dites « d’hydrolyse » de certains sels tels que NaCH3CO2 ou d’autres substances tels les chlorures d’acides, par exemple POCl3, ou tels des esters, par exemple CH3CO2C2H5.
Dans ces réactions, l’eau, légèrement dissociée en H+ et OH–, se comporte comme si ces ions allaient se fixer sur une substance antagoniste et la rompre en espèces chimiques différentes :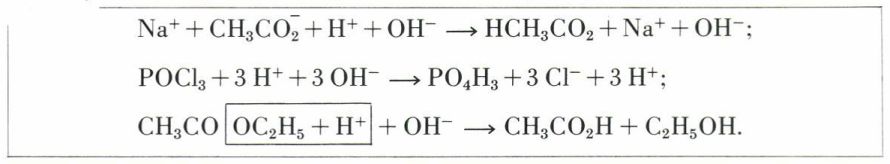
Des additions d’eau peuvent se faire avec rupture de la molécule d’eau en H et OH. Il en est ainsi dans l’addition d’eau sur une liaison éthylénique :
C2H4 + H2O → CH3—CH2OH
(en présence d’acide sulfurique).
L’eau agit aussi sur les anhydrides d’acides ou sur certains oxydes basiques. Ainsi,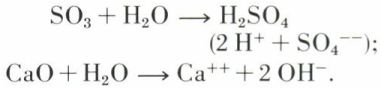
On appelle parfois également ces réactions des hydrolyses.
D’autre part, l’eau peut être réduite par diminution de la charge de l’hydrogène :
H+ + e → 1/2 H2,
E0 = 0 volt par définition.
Cet équilibre d’oxydoréduction en solution aqueuse permet la réalisation d’une « électrode d’hydrogène » par de l’hydrogène barbotant dans une solution aqueuse d’activité déterminée en ion hydrogène au contact d’une électrode de platine platiné (c’est-à-dire recouvert de platine divisé).
On appelle électrode d’hydrogène cet ensemble, et l’électrode normale d’hydrogène est réalisée avec une électrode dont la pression ou, mieux, la fugacité du gaz hydrogène est d’une atmosphère et l’activité des ions hydrogène de la solution a la valeur unité, sensiblement réalisée avec une solution à 1,25 mole d’acide chlorhydrique par litre. On préfère utiliser actuellement l’« électrode de verre », qui est d’un emploi plus commode pour les mesures de pH. Il en résulte que les métaux très réducteurs qui ne se recouvrent pas d’une couche protectrice formée de produits de leur réaction libèrent l’hydrogène de l’eau liquide. Ainsi,
Na + H2O → Na+ + OH– + 1/2 H2.
Un certain nombre de métaux moyennement électropositifs (donc réducteurs), le carbone et l’oxyde de carbone peuvent réduire l’eau à chaud (v. hydrogène, carbone, fer).
Mais l’eau peut être oxydée, et cela correspond à la libération de l’oxygène combiné dans l’eau selon le système d’oxydoréduction
H2O ⇄ 1/2 O2 + 2 H+ + 2e–,
dont le potentiel est
Il en résulte que l’eau ne peut être oxydée que par les corps très oxydants (fluor) et agit alors comme un réducteur.
À chaud se produit la réaction
Cl2 + H2O → 2 HCl + 1/2 O2,
qui est la réaction inverse de la préparation du chlore par le procédé Deacon.
Lorsqu’on électrolyse de la soude ou de l’acide sulfurique en solution dans l’eau, le résultat est une électrolyse de l’eau avec dégagement d’hydrogène à la cathode et d’oxygène à l’anode.
H. B.
L’eau dans la nature
Volume
L’eau joue dans la biosphère un rôle essentiel. Elle représente, en poids, le composant le plus important de la matière vivante. Elle occupe moins de volume que l’air, mais sa masse est infiniment plus importante.
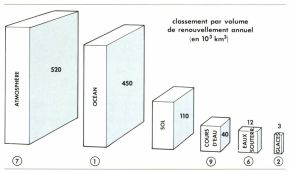
Les réserves totales à l’échelon mondial sont évaluées à 1,36.109 km3, les mers et les océans représentant 97,2 p. 100 de ce total.
Si l’eau était répartie uniformément à la surface de la Terre, elle formerait une nappe de près de 3 000 m : 2 700 m correspondraient à la masse des océans, une centaine de mètres répondraient à la masse immobilisée par les glaciers, une quarantaine de mètres représenteraient les eaux souterraines. L’ensemble des eaux douces de la Terre ne constituerait qu’une pellicule de 40 cm d’épaisseur ; la vapeur d’eau contenue dans l’atmosphère, si elle se condensait en totalité, ne donnerait qu’une couche de 3 cm. Ces chiffres n’ont qu’une valeur indicative : pour l’eau contenue dans le sous-sol ou celle qui est immobilisée dans les calottes glaciaires, les évaluations varient encore du simple au double. Aussi imparfaits qu’ils soient, ils ont le mérite de montrer que l’eau utile pour les êtres vivant sur les continents ne correspond qu’à une toute petite fraction de la masse liquide de la Terre : 3 p. 100 si l’on compte les eaux souterraines et les glaces, nettement moins de 1 p. 100 si on les néglige.

L’eau et les plantes
L’eau doit son importance, au niveau de la vie animale et végétale, aux possibilités que son pouvoir solvant lui confère en matière de transport ; elle la doit, aussi, à sa place dans l’architecture d’une bonne part des tissus vivants. Le premier rôle nécessite la mise en mouvement de masses d’eau bien plus considérables que le second. Pour les plantes, il y a ainsi de l’eau en transit, puisée dans le sol et livrée à l’évaporation, et de l’eau de constitution. L’eau de transit permet à la plante de tirer du sol les éléments nutritifs qui lui sont nécessaires. Pour une récolte qui pèse, verte, 20 t, l’eau de transit représente les trois quarts, 15 t, cependant que l’eau de constitution a une masse égale à trois des cinq tonnes de matière sèche. Si on compare ces quantités à celles qui ont été consommées pour arriver à ce résultat, la disproportion entre eau de transit et eau de constitution s’accroît : pour obtenir les 20 t de produits récoltés, 2 000 t d’eau ont été prélevées au sol et livrées à l’évaporation et à la transpiration.




