alcalins (éléments et composés) (suite)
État naturel
Le chlorure de sodium est le minerai usuel ; c’est le sel utilisé en cuisine, qui peut être du sel marin obtenu par évaporation de l’eau de mer ou du sel gemme cristallisé dans la terre. On trouve aussi le carbonate, le sulfate, le borate et le nitrate, ainsi que des silicates (certains feldspaths).
Le potassium est largement distribué dans le sol sous forme de composés (particulièrement du chlorure souvent combiné à d’autres chlorures), mais les gisements de chlorure de potassium connus et exploitables sont moins nombreux que ceux de sels de sodium. On trouve aussi du potassium dans des silicates naturels tels que certains feldspaths ou micas.
Le sodium et le potassium sont relativement abondants dans les couches superficielles de la terre, puisque le sodium en constitue 2,63 p. 100 en poids et le potassium 2,40 p. 100. Ainsi, le sodium est le sixième élément par importance décroissante en poids dans les couches superficielles terrestres, et le potassium en est le septième. Le lithium est rare à la surface de la terre et se concentre dans quelques composés minéraux, des silicates tels que la lépidolite ou des phosphates. Le rubidium et le césium sont très rares.
Atomes
Les atomes sont caractérisés par le fait que, dans leur état fondamental, leur cortège électronique possède un seul électron sur la couche la plus externe. Il en résulte le symbolisme suivant, qui caractérise l’état fondamental de ces atomes :
pour le lithium, symbole Li : 1s2, 2s1 ;
pour le sodium, symbole Na : 1s2, 2s2, 2p6, 3s1 ;
pour le potassium, symbole K : 1s2, 2s2, 2p6, 3s2, 3p6, 4s1 ;
pour le rubidium, symbole Rb : 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 5s1 ;
pour le césium, symbole Cs : 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 5s2, 5p6, 6s1.
Ces éléments occupent la première colonne du tableau périodique. Il résulte de cette structure que l’électron unique du plus haut nombre quantique principal est assez faiblement uni au noyau de l’atome. D’où les valeurs suivantes de l’énergie nécessaire pour arracher cet électron externe (traduite par le potentiel de première ionisation exprimée en électrons-volts), les valeurs du rayon atomique et celles du rayon des cations M+ correspondant au résultat de la perte de l’électron externe en angströms (Å) :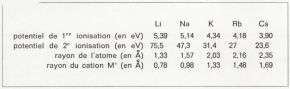
Cette faible liaison de l’électron externe avec le reste de l’atome explique les bas potentiels normaux (compris entre – 3,0 et 2,7 volts) des couples respectifs d’oxydoréduction : M ⇄ M+ + e–, où M représente le métal et M+ le cation. Elle explique aussi la monovalence des éléments alcalins. Ces éléments sont donc très électropositifs.
C’est aussi cette facilité d’arrachement de l’électron externe et, d’ailleurs, de ce seul électron qui explique que les éléments alcalins soient presque toujours sous forme de cations dans les composés et que ces métaux soient très réactifs. Dans quelques cas, en particulier avec des dérivés organométalliques, la liaison de l’élément alcalin avec son unique plus proche voisin prend un caractère partiellement covalent.
Le potassium et le rubidium naturel sont radio-actifs par suite de la présence de très faibles proportions d’un noyau radio-actif pour chacun.
Les métaux alcalins
Les corps simples formés par les éléments alcalins ont à l’état solide un net caractère métallique, qui se traduit par l’éclat brillant des métaux fraîchement coupés et par leur haute conductibilité.
Voici quelques propriétés de ces métaux :
Ces métaux, très réactifs, sont des réducteurs énergiques. Ils s’oxydent et réagissent facilement avec certains corps simples dont l’atome est électronégatif, comme les halogènes. Ils réagissent avec l’hydrogène pour donner un hydrure solide.
En particulier, l’eau réagit à la température ordinaire avec le sodium et le potassium, avec production d’hydroxyde et dégagement d’hydrogène :
M + H2O → MOH + 1/2 H2.
Le sodium est obtenu par électrolyse de l’hydroxyde de sodium fondu, et près de la moitié de la quantité fabriquée industriellement sert à faire le plomb tétraéthyle, qui, mélangé à l’essence, sert d’antidétonant.
Principaux dérivés du sodium
Le chlorure de sodium est la matière de base d’où dérivent tous les composés industriels du sodium. Les principaux produits ainsi fabriqués sont l’hydroxyde (la soude NaOH), le carbonate Na2CO3 et le carbonate acide NaHCO3.
On obtient la soude par électrolyse d’une solution aqueuse de chlorure de sodium. À la cathode, on a formation de soude et d’hydrogène ou, dans certains cas, d’un amalgame de sodium que l’on convertit ultérieurement en présence d’eau avec formation de soude et dégagement d’hydrogène. À l’anode, on a un dégagement de chlore. Les solutions aqueuses de soude comme celles des autres hydroxydes alcalins sont nettement basiques.
On obtient industriellement le carbonate acide de sodium peu soluble dans l’eau par le procédé Solvay. Un barbotage d’anhydride carbonique dans une saumure ammoniacale produit ce carbonate acide de sodium, qui, peu soluble dans le milieu, précipite selon la réaction
NaCl + NH4HCO3 ⇄ NaHCO3 + NH4Cl.
Auparavant (depuis le règne de Napoléon Ier), le carbonate de sodium était fabriqué par le procédé Leblanc. Celui-ci repose sur les réactions suivantes :
2 NaCl + H2SO4 → Na2SO4 + 2 HCl ;
puis dans un four :
Na2SO4 + 2 C → Na2S + 2 CO2 ;
et finalement :
Na2S + CaCO3 → Na2CO3 + CaS.
À très peu d’exceptions près, les sels de sodium sont assez solubles dans l’eau.
Le dérivé naturel d’où provient le potassium et la plupart des composés de potassium est le chlorure.
Les propriétés des dérivés homologues des métaux alcalins sont très analogues. Le potassium étant plus cher que le sodium, l’emploi de certains sels de potassium provient des propriétés fertilisantes spéciales du potassium.




