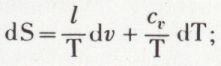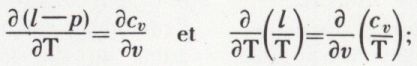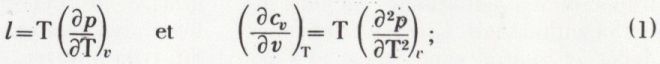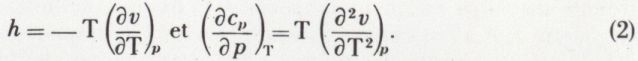codification (suite)
Mais surtout la France offre depuis quelques années l’exemple type de la codification administrative par « textes réglementaires codifiés ». Normalement, on réserve le titre de codes aux codes législatifs ; cependant, des décrets viennent s’y ajouter, des règlements traitent des mêmes questions, des circulaires donnent de nouvelles précisions. La question se pose donc de savoir comment présenter ces diverses dispositions ; deux solutions ont été préconisées par la commission dite « de précodification » (nommée en 1948) ou « commission supérieure pour l’étude de la codification et de la simplification des textes législatifs et réglementaires ».
La première qui fut adoptée est celle d’un code comprenant normalement deux parties (L, législatif ; R, règlements publics et décrets en Conseil d’État) et éventuellement plus (D, décrets simples ; C, circulaires). C’est le cas, par exemple, du nouveau Code électoral de 1964 (L, R), de même qu’on a ajouté en 1958 une partie R au Code pénal. La seconde solution est celle du code purement réglementaire (cas du Code des marchés publics du 17 juillet 1964 [R, D]). Par ailleurs, depuis la Constitution de 1958 (art. 34), le champ d’application de la loi est considérablement réduit au profit du pouvoir réglementaire ; les règlements autonomes sont donc de plus en plus nombreux, et les codes législatifs envahis de dispositions devenues réglementaires (en fait, la forme réglementaire ne leur est donnée qu’au moment de leur modification). D’une manière générale, on parle maintenant de codes législatifs et réglementaires, d’une part, et de codification administrative et réglementaire (laquelle reprend souvent des lois anciennes se rapportant à la matière traitée), d’autre part. Cette dernière prend de plus en plus d’importance (Codes des pensions militaires d’invalidité et des victimes de guerre, des lotissements, de la pharmacie, des caisses d’épargne, de l’urbanisme et de l’habitation, de l’artisanat*, etc.).
On doit distinguer, en outre, entre les codes législatifs d’origine, les codes ratifiés par le législateur, qui ont ainsi une valeur propre, et les codes non ratifiés, pour lesquels le texte législatif d’origine prime le texte codifié chaque fois qu’il y a contestation (sauf lorsqu’une modification législative postérieure se réfère directement au texte du code).
M.-A. L.
N. Hozumi, Lectures on the New Japanese Civil Code (Tōkyō, 1904 ; 2e éd., 1912). / J. Van Kan, les Efforts de codification en France (Rousseau, 1929). / E. Frankenstein, Projet d’un code européen de droit international privé (Brill, Leyde, 1950). / B. Schwartz (sous la dir. de), The Code Napoleon and the Common-Law World (New York, 1954). / R. David, les Grands Systèmes de droit contemporains (Dalloz, 1963). / J. Vanderlinden, le Concept de code en Europe occidentale du xiiie au xixe siècle (Institut de sociologie, Bruxelles, 1967).





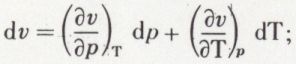
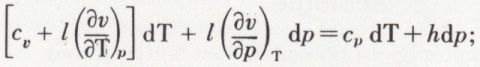
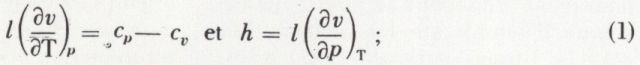
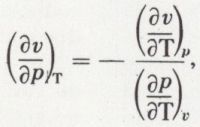

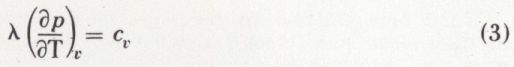
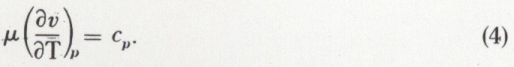



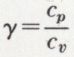 est constant. On obtient p.vγ = constante ; c’est l’équation de Laplace.
est constant. On obtient p.vγ = constante ; c’est l’équation de Laplace.