verre (suite)
Ces conditions imposent la formation d’un réseau tridimensionnel peu compact. Outre la silice SiO2, l’anhydride borique B2O3 et l’anhydride phosphorique P2O5 sont effectivement connus sous forme vitreuse. Les cations correspondants Si4+, B3+ et P5+ sont dits formateurs de verres, et les ions oxygène assurant la liaison sont dits oxygènes pontants. Ce sont ces liaisons qui se relâchent plus ou moins sous l’effet de la température et provoquent la diminution de la viscosité. Lorsqu’on introduit dans le réseau un tiers élément M, tel qu’un ion alcalin (Na+) ou alcalino-terreux (Ca2+), il n’arrive pas seul, car, pour être ionisé lors de la fonte, il doit provenir d’un sel généralement oxygéné : c’est le cas pour le sulfate de sodium SO4Na2, le carbonate de sodium CO3Na2 ou le carbonate de calcium CO3Ca, qui sont d’ailleurs, avec le sable, les constituants majeurs des verres courants. Ces corps étaient appelés des fondants (Na) ou des stabilisants (Ca). Les molécules d’oxygène apportées ainsi en supplément des autres molécules d’oxygène figurant dans les oxydes des formateurs contribuent à rompre la liaison suivant le schéma ci-dessous :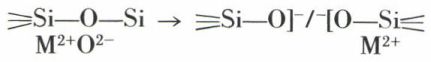
De tels oxygènes sont dits non-pontants. Ils correspondent à la coupure de liaison covalente forte au profit d’une liaison ionique labile. Le cation M joue le rôle essentiel dans la conductivité, car, peu lié, il reste relativement mobile. Ne participant pas directement à la formation du réseau, il en modifie cependant les propriétés. On désigne de tels cations sous le nom de modificateurs. Le réseau ainsi affaibli permet une plus grande fluidité, qui peut aller jusqu’à autoriser les réarrangements nécessaires pour une cristallisation. Ainsi, si le verre de silice SiO2, avec son rapport 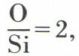 ne comporte que des oxygènes pontants et est encore visqueux à 2 000 °C, le métasilicate SiO2,
ne comporte que des oxygènes pontants et est encore visqueux à 2 000 °C, le métasilicate SiO2,  ne donne que de mauvais verres et le métasilicate, avec un rapport
ne donne que de mauvais verres et le métasilicate, avec un rapport 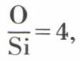 n’est pas obtenu sous forme vitreuse. Pourtant, lorsque les cations modificateurs M sont nombreux et variés en charge et en diamètre, ils gênent une cristallisation éventuelle, et leurs répulsions mutuelles contribuent à maintenir un certain équilibre désordonné à l’intérieur des bribes de réseau restant, en conduisant à des verres inversés.
n’est pas obtenu sous forme vitreuse. Pourtant, lorsque les cations modificateurs M sont nombreux et variés en charge et en diamètre, ils gênent une cristallisation éventuelle, et leurs répulsions mutuelles contribuent à maintenir un certain équilibre désordonné à l’intérieur des bribes de réseau restant, en conduisant à des verres inversés.
Pour rendre compte du désordre à grande distance, Aleksandr Alekseïevitch Lebedev admettait, dès 1921, qu’à courte distance des microcristaux de composés définis intervenaient, mais que ces cristallites étaient désorientés les uns par rapport aux autres dès qu’on observait un volume suffisant. À partir de 1936, Warren a supputé la formation d’un réseau tridimensionnel continu, mais affecté d’erreurs de construction qui finissaient par masquer toute périodicité du réseau. Aujourd’hui, on s’accorde à penser que les deux hypothèses sont nécessaires pour rendre compte de l’ensemble des propriétés des états vitreux. Cependant, elles ne constituent que des cas limites, idéaux. On peut admettre que le réseau lâche qui caractérise l’état vitreux et qui se construit à partir d’un germe essaie de respecter des stœchiométries locales, mais accepte des défauts qui contribuent à distordre le cristal en formation. Lors de sa croissance, celui-ci rejette à la périphérie ce qui n’est pas directement utilisable pour la construction en cours et dont l’accumulation à la périphérie interdit la poursuite. Il apparaît une zone frontière au-delà de laquelle le processus de croissance peut recommencer.
Le verre apparaîtrait ainsi comme par essence granulaire, et ses granulations ont été effectivement observées au microscope électronique dans de multiples occasions.
I. P.
➙ Four / Verrerie / Vitrocérame.
J. D. Mackenzie, Modern Aspects of the Vitreous State (Londres, 1960-1962 ; 2 vol.). / W. A. Weyl et E. C. Marboe, The Constitution of Glasses. A Dynamic Interpretation (Londres, 1963-1967 ; 2 vol.). / W. Eitel, Silicate Science. A Treatrise, t. II : Glasses, Enamels, Slags (New York, 1965). / H. Scholze, Glas. Natur, Struktur und Eigenschaften (Brunswick, 1965 ; trad. fr. le Verre. Nature, structure et propriétés, Institut du verre, 1969). / P. Piganiol, les Industries verrières (Dunod, 1966).




