verre (suite)
Dévitrification
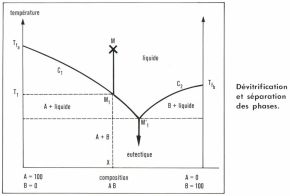
Si l’on considère un diagramme de phase simplifié, correspondant à deux constituants A et B, pour composition donnée X du bain fondu, représentée dans cet état par le point figuratif M, le refroidissement se traduira d’abord par un déplacement de ce point parallèlement à l’axe des températures jusqu’à atteindre la courbe frontière C1 en M1. À partir de cette température du liquidus, T1, le constituant le moins fusible commence à se déposer, et le liquide surnageant s’enrichit en l’autre constituant. Le point figuratif se déplace alors de M1 en M′1, à partir duquel les deux corps se déposent ensemble (eutectique). Dans le cas des verres industriels, les choses sont plus compliquées, puisqu’il y a de nombreux constituants dont le mélange ne correspond à aucune stœchiométrie ; mais le modèle simplifié précédent permet de comprendre le processus de la dévitrification. Le diagramme de phase correspondant aux verres silico-sodo-calciques montre des domaines de stabilité de différents composés : la silice SiO2, sous forme de cristobalite, de tridymite et de quartz ; la wollastonite CaO, SiO2 ; les composés Na2O, 3CaO, 6SiO2 (dit 1 : 3 : 6), Na2O, 2CaO, 3SiO2 et enfin Na2O, 2SiO2. Pour un verre fondu donné, le point figuratif tombe dans l’un de ces domaines, mais n’est en équilibre avec le composé correspondant que pour une seule température. Au-dessus, ce composé se dissout dans le liquide ; au-dessous, il s’en sépare. Au cours d’un refroidissement lent, la première phase cristalline qui apparaîtra est celle dans laquelle se trouvait le point figuratif initial, et cela à la température dite de cristallisation commençante ; les cristallisations successives apparaissent ensuite. Pour un verre composé de 74 p. 100 de silice (SiO2), de 13 p. 100 de chaux (CaO) et de 13 p. 100 de soude (Na2O), les premiers cristaux apparaissent à 1 100 °C et sont constitués par de la tridymite.
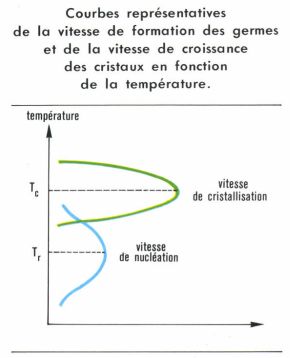
La dévitrification est un accident que redoute le verrier. Pour qu’elle se produise, il faut que le verre fondu stagne un temps suffisant à la température convenable et que des conditions particulières altèrent la symétrie des champs moléculaires. C’est ainsi qu’une discontinuité du milieu (interface verre/réfractaire, interface verre/bulle, hétérogénéité constituée par deux verres non parfaitement mélangés [cordes, gommes, etc.]), la présence d’un corps étranger (pierre), mais surtout la présence de germes sont autant de facteurs déterminants pour entraîner la dévitrification. On lutte contre cette tendance en introduisant de l’alumine ou de la magnésie dans la composition et en évitant de laisser séjourner le verre à la température où le phénomène a le plus de chance de se produire. Deux phénomènes commandent en effet la dévitrification : la vitesse de formation des germes et la vitesse de croissance des cristaux. Les deux courbes V = f(T) passent par des maximums qui ne coïncident pas. Elles peuvent même ne pas se recouper. Il est possible qu’à la température où les cristaux pourraient se développer il n’y ait pas de germes, et, lorsque ceux-ci apparaissent, les cristaux qu’ils engendreraient ne peuvent pas se développer. Cette situation, favorable pour la vitrification, doit être modifiée si l’on entend justement produire une dévitrification. La nucléation peut apparaître spontanément ou être provoquée. Dans le premier cas, elle peut résulter d’une fluctuation aléatoire due à l’agitation thermique et qui amène localement les constituants de la fonte à un rapport favorable à un début de cristallisation. En général, le domaine intéressé reste à l’état embryonnaire, et l’embryon se redissout ; mais, s’il acquiert d’emblée une dimension suffisante, cet embryon constitue un noyau à partir duquel la cristallisation peut se poursuivre. Dans le second cas, on ensemence : on provoque l’apparition de germes en utilisant la différence de solubilité d’un élément secondaire à haute et à plus basse température. Ainsi, les fluorures sont dissous à la température normale de fusion des verres, mais précipitent en très fins cristaux uniformément répartis lors du refroidissement, ce qui confère au verre un aspect laiteux (verres opales). Dans des conditions analogues, l’or dissous sous forme ionique précipite sous forme colloïdale, quand il passe à la forme métallique, en donnant une belle couleur rouge rubis au verre. L’argent a donné lieu à une intéressante particularité : lorsqu’il est dissous dans le verre sous la forme ionique et en présence de sels de cérium, on observe un transfert de charge sous l’influence d’un photon, suivant l’équation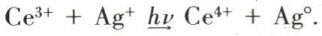
Les germes d’argent métallique formés sous l’action de la lumière seront ensuite développés par un traitement thermique convenable en colorant le verre là seulement où il aura été frappé par la lumière (verres photosensibles). Si l’on favorise la cristallisation des silicates eux-mêmes, par exemple en choisissant un verre de base SiO2—Li2O, les microcristaux obtenus comme précédemment sous l’influence de la lumière seront plus attaquables que la phase restée vitreuse et pourront être éliminés. On peut ainsi graver et percer les verres par report photographique.
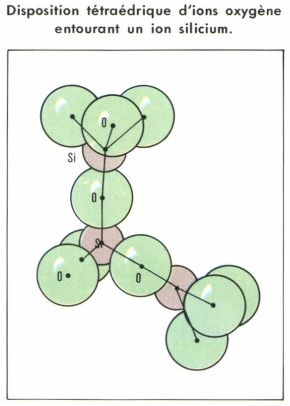
Structure moléculaire des verres
Toute hypothèse structurale doit rendre compte du fait que les verres ayant des propriétés isotropes, au moins à l’échelle macroscopique, doivent présenter à cette échelle une structure désorganisée. Pourtant, les spectres de rayons X montrent qu’à courte distance, à l’échelle moléculaire, il règne un certain ordre. Ainsi, le motif structural des verres à base de silice est le même et est constitué par une disposition tétraédrique d’ions oxygène entourant un ion silicium. On le représente par [SiO4]. Chaque ion oxygène est le point de départ d’un autre tétraèdre, de sorte que, globalement, la formule est SiO2.
Zachariasen a énoncé dès 1931 les règles générales auxquelles semblent répondre les oxydes aptes à donner des verres et auxquelles satisfont effectivement les oxydes R2O3, RO2 et R2O5.
1. La coordinance du cation R doit être petite.
2. L’oxygène ne peut être lié à plus de deux cations.
3. Les polyèdres constitués par les oxygènes ne peuvent avoir qu’un sommet commun et non une arête ou une face.
4. Trois sommets au moins de chaque polyèdre doivent appartenir en même temps à d’autres polyèdres.