titane (suite)
Atome
Son numéro atomique est 22. Il appartient donc à la première série de métaux de transition dans le groupe IV A, et la structure électronique de l’atome dans son état fondamental est représentée par le symbole 1s2, 2s2, 2p6, 3s2, 3p6, 3d6, 4s2. Les premières énergies successives d’ionisation sont 6,83 eV ; 13,83 eV ; 28,14 eV ; 43,24 eV ; puis 100 eV.
Le rayon atomique est de 1,32 Å, et le rayon du cation Ti+4 de 0,68 Å.
Corps simple
C’est un métal assez léger, de masse volumique 4,5 g/cm3, qui fond à 1 725 °C, c’est-à-dire un peu plus bas que le zirconium (1 860 °C) et a fortiori que le hafnium (2 200 °C). Ses propriétés mécaniques sont comparables à celles de l’acier, et il doit se travailler à froid, car au rouge, il brûle dans l’oxygène et, vers 800 °C, il donne un nitrure TiN avec l’azote. Il réagit avec un certain nombre d’autres métalloïdes (H2, F2, Cl2, S, C, Si). Il se dissout dans les acides, mais il résiste bien aux solutions salines et aux solutions acides diluées, alors que les bases alcalines l’attaquent en présence d’air.
En traitant le minerai de titane par le coke au rouge au contact de chlore, on obtient le tétrachlorure TiCl4, que l’on purifie par distillation et que le magnésium réduit avec libération du titane métallique.
Composé
Le titane — comme ses homologues, zirconium et hafnium — présente de nombreux composés que l’on rattache à plusieurs nombres d’oxydation + II, + III et + IV.
Des dérivés du titane II sont obtenus par une réduction convenable de dérivés du titane IV au moyen de réducteurs puissants comme l’amalgame de sodium : ces composés du titane II sont peu stables et très réducteurs. Le couple d’oxydoréduction Ti+2 ⇆ Ti+3 + e– a un potentiel normal de 0,37 V. Des dérivés du titane III sont obtenus par réduction modérée de dérivés du titane IV et sont réducteurs. Le titane a tendance à donner des dérivés correspondant au nombre d’oxydation IV comme dans ses minerais : oxyde, titanates. L’oxyde de titane TiO2, étant un oxyde acide, se combine à des oxydes basiques pour donner des oxydes multiples appelés titanates : mais beaucoup de ces titanates ne contiennent pas un anion bien individualisé ; ainsi, le titanate de baryum (utilisé pour sa ferro-électricité et par-là sa piézo-électricité) a une structure solide comportant un réseau tridimensionnel d’octaèdres d’oxygène, et à l’intérieur de ces octaèdres se trouve le titane.
L’eau oxygénée forme avec les sels de titane des dérivés peroxotitaniques associés à une coloration orange intense. On peut en précipiter l’acide peroxotitanique. On connaît des complexes du titane, en particulier des sels contenant l’anion 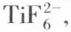 des chélates ou des composés d’addition du tétrachlorure avec des bases de Lewis (alcools, éthers).
des chélates ou des composés d’addition du tétrachlorure avec des bases de Lewis (alcools, éthers).
H. B.
Élaboration du métal
Parmi les nombreux composés minéraux contenant du titane et abondants dans l’écorce terrestre, seuls l’oxyde TiO2 sous la forme cristallisée allotropique (le rutile) et le titanate de fer FeTiO3 (l’ilménite) [extrait à l’origine des monts Ilmen en Russie] sont utilisés comme minerais industriels. Le rutile titrant jusqu’à 58 p. 100 en titane est exploité aux États-Unis, en Autriche et au Cameroun. L’ilménite se rencontre dans des gisements de fer titané, ou titanomagnétites, contenant de 7 à 15 p. 100 de titane et des oxydes de fer (hématite et magnétite) ; les gisements les plus riches sont exploités aux États-Unis, au Canada, en U. R. S. S., en Inde, en Guinée, en Suède et en Norvège.
Aucun procédé de réduction directe des composés oxydés du titane n’étant utilisable pour sa préparation industrielle, on opère par décomposition d’un composé halogène (iodure, chlorure). La décomposition thermique du tétra-iodure TiI4 (procédé Van Arkel - de Boer) autorise certes l’obtention de titane très pur à 99,95 p. 100, mais en quantités limitées. Pour cela, on chauffe électriquement vers 1 400 °C un filament de titane dans de la vapeur de tétra-iodure de titane. L’iodure se dissocie à la surface du filament chaud en déposant une couche de métal cristallisé, et l’iode libéré vient réagir sur du titane impur placé dans une zone de la chambre de réaction à une température de 550 °C, en reformant du tétra-iodure de titane. De façon continue, le filament de titane grossit et forme un barreau, mais son diamètre est limité, car il faut maintenir en surface la température élevée qui permet la dissociation de la vapeur.
Le procédé industriel mondialement utilisé fait appel à la décomposition du tétrachlorure de titane par le magnésium, suivant la technique imaginée par W. J. Kroll en 1936. On obtient d’abord du tétrachlorure de titane à l’état gazeux par réaction du minerai oxydé, convenablement préparé, avec le chlore en présence de carbone, vers 800 °C. Après condensation, puis distillation fractionnée permettant sa purification, le gaz est envoyé dans un réacteur contenant des lingots de magnésium sous atmosphère neutre. À la suite d’un chauffage d’amorçage, la réduction du tétrachlorure par le magnésium fondu se continue vers 800 °C, suivant la réaction exothermique
TiCl4 + 2 Mg → 2 MgCl2 + Ti.
Le titane ainsi déposé en masse spongieuse (éponge de titane) contient du magnésium et du chlorure de magnésium entraînés qui sont éliminés par lavages et distillation sélective sous vide. Pour obtenir du titane à 99,5 p. 100 sous forme de lingots, l’éponge est refondue dans un four à arc sous atmosphère neutre d’argon ou sous vide pour éviter la contamination gazeuse du métal, particulièrement réactif. L’entraînement dans le métal fondu d’éléments de l’électrode est supprimé par l’emploi d’une électrode consommable en titane pur ou allié.

Emplois
Le titane est apprécié pour la combinaison de ses trois qualités de base : bonne résistance à la corrosion, caractéristiques mécaniques intéressantes et faible masse volumique. À partir de 1948 se sont développées les applications industrielles du métal, lorsque ont été résolues les difficultés d’élaboration du « titane ductile », ce qui a autorisé son formage mécanique (fragilité causée par certains gaz, attaque des réfractaires par le métal fondu). Ainsi, la production de titane aux États-Unis, qui était de 50 t en 1950 et de 7 000 t en 1960, a atteint 20 000 t en 1973. Ce sont les industries chimique, aéronautique et aérospatiale qui ont le plus bénéficié de l’utilisation du métal et de ses alliages.




