thermochimie (suite)
Un groupe de mesures important est celui de la chaleur de combustion, sous la pression atmosphérique, de combustibles gazeux (gaz de houille, gaz naturel, etc.). On utilise pour cela un calorimètre de Junkers (fig. 2) : il comporte essentiellement une cheminée, à la base de laquelle le mélange de combustible et de comburant (oxygène ou air) est introduit, et brûle ; les parois de la cheminée, minces et conductrices de la chaleur, sont refroidies par un courant d’eau à laquelle les gaz résultant de la combustion abandonnent la presque totalité de la chaleur de la réaction. Pour un régime permanent, correspondant à un débit constant de combustible, on a nQ = m (t1 – t0) + q – m′L, n étant le débit du combustible en moles par unité de temps, Q la chaleur dégagée par la combustion d’une mole, t0 et t1 les températures d’entrée et de sortie de l’eau, dont le débit est m grammes par unité de temps ; q est un terme correctif qui tient compte de la chaleur évacuée par les gaz brûlés ; m′ est la masse d’eau condensée dans la cheminée et recueillie par unité de temps, L sa chaleur massique de vaporisation. On obtient ainsi le pouvoir calorifique inférieur du combustible (que l’on rapporte ordinairement au kilogramme ou au mètre cube), vapeur d’eau non condensée ; le pouvoir calorifique supérieur s’obtient en ajoutant au précédent la chaleur de vaporisation de l’eau de combustion.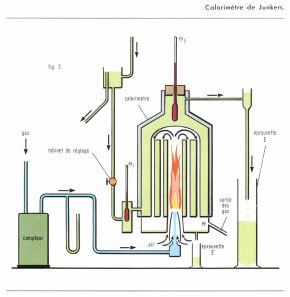
La mesure des faibles chaleurs de réaction et des chaleurs de réactions lentes s’effectue dans un calorimètre adiabatique ou dans un calorimètre différentiel, ou encore par les procédés de la microcalorimétrie.
• Détermination indirecte d’une chaleur de réaction par application du principe de l’état initial et de l’état final. Une mesure directe est parfois difficile ou imprécise ( par exemple). Mais on peut déduire la chaleur de cette réaction de celles de la formation de CO2 :
par exemple). Mais on peut déduire la chaleur de cette réaction de celles de la formation de CO2 :
et de la combustion de CO :
dont la mesure directe est facile et précise. On applique pour cette détermination indirecte le principe de l’état initial et de l’état final, qui s’énonce ici : la chaleur d’une réaction à p constant (ou à v constant) est indépendante de l’existence, du nombre et de la nature des réactions intermédiaires par lesquelles on peut imaginer de passer pour effectuer la réaction proposée. Pour passer du mélange de carbone et d’oxygène au monoxyde de carbone, on peut soit opérer directement (ΔH = x), soit passer par l’intermédiaire CO2 : ΔH1 = – 94, puis de CO2 à CO en imaginant d’effectuer la réaction inverse de la combustion de CO : ΔH2 = + 68 ; d’où :
x = ΔH1 + ΔH2 = – 26 kcal.
En considérant la réaction :
on déduit de ce qui précède une règle pratique, dite « de Hess » : la chaleur d’une réaction est égale à la somme des chaleurs de formation des corps produits, diminuée de la somme des chaleurs de formation des corps réagissants. Cette règle facilite dans bien des cas l’application du principe des états initial et final.
• Chaleur de liaison. On trouve habituellement dans les tables les chaleurs de formation des composés à partir des éléments pris dans l’état où on les rencontre à 25 °C, 1 atm : C graphite, oxygène moléculaire gazeux, etc. (quand il peut y avoir doute, on indique l’état physique ou allotropique) ; mais cet état standard de référence conventionnel résulte lui-même en général de liaisons entre atomes, liaisons
dans le graphite, O=O dans la molécule d’oxygène, etc. On peut par suite envisager la détermination des chaleurs de formation des corps, simples et composés, à partir des éléments pris à l’état monoatomique gazeux. Plus que les méthodes chimiques, souvent inapplicables, les méthodes physiques, en particulier celles qui sont fondées sur l’étude des spectres, permettent de déterminer un certain nombre de chaleurs de liaison atomique : chaleur de sublimation du graphite (170 kcal/mole), de dissociation des molécules O2 (118 kcal/mole), H2 (104 kcal/mole), etc. L’application de la règle de Hess à une réaction, par exemple :
C (graphite) + 2 H2 → CH4 (ΔH = – 18 kcal),
permet de calculer, en prenant comme référence l’état monoatomique gazeux, la chaleur de formation de CH4 : – 396 kcal, et par suite, pour une quelconque des quatre liaisons C—H dans le méthane, la chaleur de liaison
– 396/4 = – 99 kcal/mole
(– 4,3 eV par liaison entre deux atomes). Si dès lors on admet que la chaleur d’une liaison localisée est, en première approximation, indépendante de la molécule dans laquelle elle est observée, on peut, de proche en proche, déterminer d’autres chaleurs de liaison
(C—C : – 83 kcal/mole ; C=C : – 146 kcal/mole, etc.)
et par suite, à l’inverse, prévoir, pour une formule donnée, sa chaleur de formation. Les résultats ainsi obtenus sont suffisamment cohérents pour justifier l’hypothèse faite, du moins comme première approximation, pour permettre de déceler l’existence, dans certaines molécules, de liaisons non localisées et d’effectuer dans ce cas un calcul de l’énergie de résonance (v. liaisons chimiques).
• Influence de la température sur les chaleurs de réaction. Elle se déduit de l’application du principe de l’état initial et de l’état final. Considérons une réaction A → B, A étant l’ensemble des corps réagissants, B celui des produits. Pour passer de l’état initial A, pris à t1 °C, à l’état final B, pris à t2 °C, on peut ou bien effectuer la réaction à t1°, puis chauffer les produits de t1 à t2, ou bien chauffer les corps réagissants de t1 à t2, puis effectuer la réaction à t2° ; il en résulte  étant la capacité calorifique des corps réagissants, CB celle des produits ; d’où
étant la capacité calorifique des corps réagissants, CB celle des produits ; d’où  égalité due à Kirchhoff* (1858), valable aussi bien à volume constant (Q = ΔU, CA et CB capacités calorifiques à v constant) qu’à pression constante (Q = ΔH, CA et CB capacités calorifiques à p constant). On dispose de tables donnant les chaleurs spécifiques de nombreux corps purs en fonction (déduite d’expériences) de la température ; il suffit alors qu’une chaleur de réaction ait été mesurée à une température, par exemple 25 °C, pour que l’on puisse la calculer dans tout un domaine de températures.
égalité due à Kirchhoff* (1858), valable aussi bien à volume constant (Q = ΔU, CA et CB capacités calorifiques à v constant) qu’à pression constante (Q = ΔH, CA et CB capacités calorifiques à p constant). On dispose de tables donnant les chaleurs spécifiques de nombreux corps purs en fonction (déduite d’expériences) de la température ; il suffit alors qu’une chaleur de réaction ait été mesurée à une température, par exemple 25 °C, pour que l’on puisse la calculer dans tout un domaine de températures.




