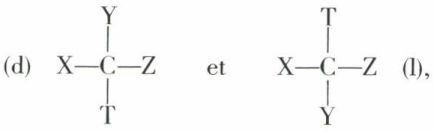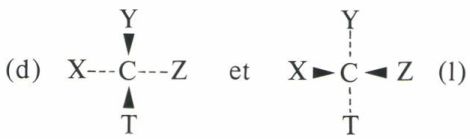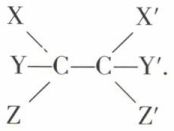Étude de la structure spatiale des composés organiques.
L’expérience avait montré que, selon les cas, à une formule développée plane, établie par analyse fonctionnelle (v. organique [chimie]), correspond ou bien un seul composé ou bien un nombre variable d’espèces distinctes. Les formules planes s’avéraient donc insuffisantes, et il était de toute nécessité d’examiner les places relatives des atomes dans l’espace ; c’est le but de la stéréochimie organique, dont les bases ont été posées par Le Bel (v. Berthelot) et Van’t Hoff* il y a un peu moins de cent ans.
Cette disposition est l’objet de la stéréochimie statique ; son évolution, au cours des réactions, relève de la stéréochimie dynamique.
Stéréochimie statique
Carbone tétraédrique
La disposition spatiale des quatre liaisons qui émanent du carbone a pu être établie récemment grâce à la mécanique quantique (hybridation Sp3). Mais elle était connue bien avant, en s’appuyant exclusivement sur des considérations de symétrie.
Nous désignerons provisoirement par X, Y, Z, T des substituants monoatomiques tous différents, pour lesquels on admet une symétrie de révolution. L’expérience montre qu’il existe un composé unique, représenté par l’une des formules CX4, CX3Y, CX2Y2, CX2YZ, ce qui n’est compatible qu’avec l’hypothèse de la non-coplanéarité des quatre substituants du carbone. Dans CX4, les quatre X occupent les quatre sommets d’un tétraèdre régulier ; dans CX3Y, l’édifice conserve trois axes ternaires et trois plans de symétrie ; dans CX2Y2 et CX2YZ, il subsiste encore un plan de symétrie. Il est à remarquer que la symétrie de ces édifices est la même que celle d’un tétraèdre régulier aux sommets duquel sont écrites les quatre lettres symbolisant les substituants. En effet, c’est sous cette forme première qu’a été énoncé le principe fondamental de la stéréochimie. « Les quatre substituants du carbone occupent les quatre sommets d’un tétraèdre régulier dont le carbone occupe le centre » :
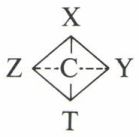
En réalité, des mesures physiques (diffraction des rayons X) ont montré que ce tétraèdre n’est pas régulier, sauf dans CX4 ; la distance C—X n’est pas égale à la distance C—Y ; l’angle 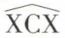 n’est pas égal à l’angle
n’est pas égal à l’angle 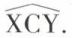 Néanmoins, l’hypothèse du « carbone tétraédrique », tel que le concevait Van’t Hoff, ne mène à aucune contradiction tant qu’il ne s’agit que de stéréochimie statique.
Néanmoins, l’hypothèse du « carbone tétraédrique », tel que le concevait Van’t Hoff, ne mène à aucune contradiction tant qu’il ne s’agit que de stéréochimie statique.
Carbone asymétrique
Quelles sont les conséquences de l’hypothèse du carbone tétraédrique dans le cas des composés CXYZT ? Un tel carbone, relié à quatre substituants tous différents, est appelé carbone asymétrique. Pour attirer l’attention sur lui dans un édifice plus complexe, on lui affecte un astérisque.
La molécule 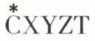 peut présenter deux configurations :
peut présenter deux configurations :
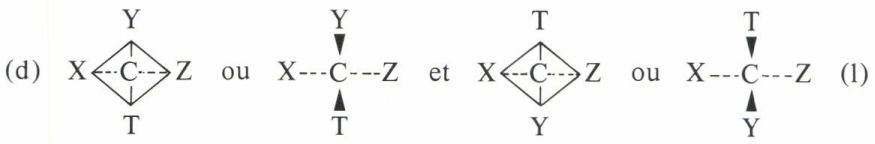
Celles-ci sont inversement égales et symétriques l’une de l’autre par rapport à un plan, le plan horizontal dans le cas de la figure.
Si nous possédons deux lots de molécules toutes identiques, l’un bâti sur le modèle (d), l’autre bâti sur le modèle (l), il est évident que les propriétés scalaires des deux lots — point de fusion, point d’ébullition, indice de réfraction, densité, solubilité dans un solvant symétrique, vitesse de réaction avec un composé symétrique, etc. — doivent être identiques. Mais on ne peut affirmer qu’il en sera de même pour les propriétés orientées. L’une d’elles est le pouvoir rotatoire naturel à l’état liquide ou en solution dans un solvant symétrique. L’un des lots, (d), par exemple, sera dextrogyre, alors que l’autre, (l), sera lévogyre, et, à l’état pur ou à concentrations égales dans un même solvant symétrique, les pouvoirs rotatoires seront égaux en valeur absolue. Nous dirons que les lots (d) et (l) sont « inverses optiques » ou énantiomorphes (on dit aussi « énantiomères »).
L’expérience montre que des lots de composés  ont ou n’ont pas le pouvoir rotatoire. S’ils ne l’ont pas, c’est que les molécules (d) et les molécules (l) y existent en nombres égaux. Un tel mélange est appelé mélange racémique ou, plus simplement, racémique. En principe, des méthodes appropriées permettent de « dédoubler » ce racémique en deux lots d’espèce unique (d) et (l), que l’on nomme antipodes optiques. Purs, ces antipodes optiques possèdent le pouvoir rotatoire maximal en valeur absolue ; il existe en effet des lots formés de (d) et de (l) en quantités inégales, dont le pouvoir rotatoire, de l’un ou de l’autre signe, est inférieur en valeur absolue à celui des antipodes optiques ; on les nomme mélanges partiellement racémisés ou partiellement déracémisés ; ils peuvent, en principe, comme les racémiques, être dédoublés.
ont ou n’ont pas le pouvoir rotatoire. S’ils ne l’ont pas, c’est que les molécules (d) et les molécules (l) y existent en nombres égaux. Un tel mélange est appelé mélange racémique ou, plus simplement, racémique. En principe, des méthodes appropriées permettent de « dédoubler » ce racémique en deux lots d’espèce unique (d) et (l), que l’on nomme antipodes optiques. Purs, ces antipodes optiques possèdent le pouvoir rotatoire maximal en valeur absolue ; il existe en effet des lots formés de (d) et de (l) en quantités inégales, dont le pouvoir rotatoire, de l’un ou de l’autre signe, est inférieur en valeur absolue à celui des antipodes optiques ; on les nomme mélanges partiellement racémisés ou partiellement déracémisés ; ils peuvent, en principe, comme les racémiques, être dédoublés.
En dehors du cas particulier des racémiques, la présence, dans une formule, d’un seul carbone asymétrique est une condition suffisante, mais non nécessaire à l’existence du pouvoir rotatoire.
• Projections conventionnelles. Elles s’inspirent de la seconde écriture des formes (d) et (l), soit
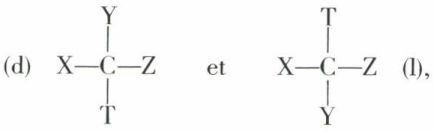
mais il faut convenir, une fois pour toutes, que les substituants écrits verticalement sont en avant du plan du tableau et que ceux qui sont écrits horizontalement sont en arrière ; en effet, les deux configurations
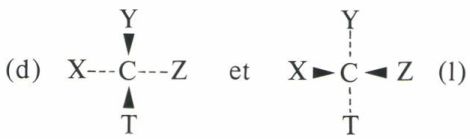
ne sont pas identiques, mais inverses optiques.
• Principe de libre rotation ou de liaison mobile. Si deux carbones sont directement reliés, les valences émanant de chacun d’eux sont confondues :
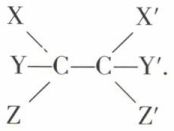
Considérons le bromure d’éthylène CH2Br—CH2Br. On n’en connaît pratiquement qu’une espèce. L’un des atomes de brome occupe-t-il vis-à-vis de l’autre une position privilégiée dans l’espace ou bien l’un des carbones et ses substituants peuvent-ils tourner librement autour de la liaison C—C ?
Ce problème a beaucoup évolué au cours des cent dernières années, et une réponse définitive a pu lui être donnée.







 n’est pas égal à l’angle
n’est pas égal à l’angle 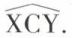 Néanmoins, l’hypothèse du « carbone tétraédrique », tel que le concevait Van’t Hoff, ne mène à aucune contradiction tant qu’il ne s’agit que de stéréochimie statique.
Néanmoins, l’hypothèse du « carbone tétraédrique », tel que le concevait Van’t Hoff, ne mène à aucune contradiction tant qu’il ne s’agit que de stéréochimie statique.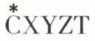 peut présenter deux configurations :
peut présenter deux configurations :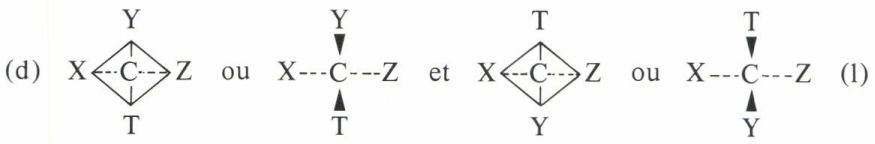
 ont ou n’ont pas le pouvoir rotatoire. S’ils ne l’ont pas, c’est que les molécules (d) et les molécules (l) y existent en nombres égaux. Un tel mélange est appelé mélange racémique ou, plus simplement, racémique. En principe, des méthodes appropriées permettent de « dédoubler » ce racémique en deux lots d’espèce unique (d) et (l), que l’on nomme antipodes optiques. Purs, ces antipodes optiques possèdent le pouvoir rotatoire maximal en valeur absolue ; il existe en effet des lots formés de (d) et de (l) en quantités inégales, dont le pouvoir rotatoire, de l’un ou de l’autre signe, est inférieur en valeur absolue à celui des antipodes optiques ; on les nomme mélanges partiellement racémisés ou partiellement déracémisés ; ils peuvent, en principe, comme les racémiques, être dédoublés.
ont ou n’ont pas le pouvoir rotatoire. S’ils ne l’ont pas, c’est que les molécules (d) et les molécules (l) y existent en nombres égaux. Un tel mélange est appelé mélange racémique ou, plus simplement, racémique. En principe, des méthodes appropriées permettent de « dédoubler » ce racémique en deux lots d’espèce unique (d) et (l), que l’on nomme antipodes optiques. Purs, ces antipodes optiques possèdent le pouvoir rotatoire maximal en valeur absolue ; il existe en effet des lots formés de (d) et de (l) en quantités inégales, dont le pouvoir rotatoire, de l’un ou de l’autre signe, est inférieur en valeur absolue à celui des antipodes optiques ; on les nomme mélanges partiellement racémisés ou partiellement déracémisés ; ils peuvent, en principe, comme les racémiques, être dédoublés.