pression
Quotient de la force exercée sur une surface par la mesure de cette surface.
Définitions et unités généralités
On désigne par contrainte le quotient de la force qui s’exerce sur un élément de surface par l’aire de cet élément. C’est un vecteur dirigé comme la force, il peut donc être oblique. Si ce vecteur est normal à la surface, on le nomme pression (s’il est tangentiel, on le nomme cission).
Dans le système international d’unités (S. I.), l’unité de pression est le newton par mètre carré, pour lequel la 14e Conférence générale des poids et mesures (1971) a adopté le nom spécial de pascal (symbole : Pa). Ce nom avait été rendu officiel en France dix ans plus tôt (décret no 61501 du 3 mai 1961).
Un rayonnement électromagnétique, lumineux par exemple, excerce sur une surface qui le reçoit une contrainte appelée improprement pression de radiation. Celle-ci n’est normale à la surface que s’il n’y a pas d’absorption ou si le rayonnement arrive sous incidence normale ; si cette dernière condition est réalisée et si, de plus, il n’y a pas d’énergie transmise, elle est égale à la densité moyenne d’énergie rayonnante au voisinage de la surface. Les forces mises en jeu par la pression de radiation peuvent être considérables dans le cas des atmosphères stellaires.
Les fluides exercent sur les parois des récipients qui les contiennent des contraintes qui sont dues aux chocs des molécules ; elles sont normales à la paroi et se réduisent donc à des pressions pour des fluides parfaits (non visqueux) ou au repos. Dans le cas des gaz parfaits, la pression s’exprime très simplement en fonction de la masse volumique ρ et de la vitesse quadratique moyenne u des molécules par la relation :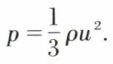
L’hydrostatique étudie les fluides au repos, c’est-à-dire en équilibre, et en particulier la distribution des pressions au sein d’un fluide en équilibre. La loi fondamentale lie le gradient vertical de pression 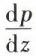 à la masse volumique ρ du fluide et à g, accélération due à la pesanteur, par la relation :
à la masse volumique ρ du fluide et à g, accélération due à la pesanteur, par la relation :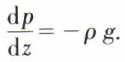
Dans le cas d’un liquide, peu compressible, on peut souvent admettre que ρ est constante. La relation ci-dessus permet d’exprimer la différence des pressions en deux points en fonction de la différence de leurs cotes :
p2 – p1 = ρg(z1 – z2).
Cela fournit une méthode de mesure de pression : soit, dans un tube en U, un liquide dont l’une des surfaces libres est soumise à une pression p1 nulle et l’autre à la pression à mesurer p2. Il suffit de mesurer la dénivellation z1 – z2 (à condition, naturellement, de connaître ρ et g). Pour cette raison on exprime souvent une pression comme une hauteur de colonne liquide équivalente, en précisant la nature du liquide. Ainsi, on utilise souvent comme unité de pression le « millimètre de mercure » ; sa valeur est environ 133 Pa.
La pression atmosphérique est la pression, en un point, de l’atmosphère. Elle est numériquement égale au poids de la colonne d’air située au-dessus de ce point et ayant pour base l’unité de surface. Elle est souvent exprimée à l’aide de multiples du pascal : le bar (105 Pa) ou le millibar (102 Pa). La valeur de la pression atmosphérique joue un rôle important, en particulier pour les points fixes des échelles thermométriques : les points d’ébullition sont les plus influencés. On a donc convenu de définir une pression de référence, appelée atmosphère normale. Primitivement définie (en 1927) par la pression exercée par une colonne de mercure de 760 mm de hauteur ayant une masse volumique de 13,595 g/cm3 et soumise à une accélération de la pesanteur de 980,665 cm/s2, l’atmosphère normale a été définie en 1954 (10e Conférence générale des poids et mesures) comme égale à 101 325 Pa. Bien que hauteur de mercure, masse volumique du mercure et accélération due à la pesanteur ne figurent plus dans la définition, il faut revenir à ces trois facteurs pour la réalisation pratique de l’atmosphère normale. L’atmosphère normale figure dans le décret du 3 mai 1961.
Les pressions réalisables et mesurables s’échelonnent sur un intervalle considérable, depuis les vides les plus poussés (10–10 Pa) obtenus en laboratoire (v. vide) jusqu’aux hautes pressions utilisées dans l’industrie (1010 Pa) et la recherche.
On appelle manomètre tout appareil destiné à mesurer une pression. On réserve le nom de baromètres à ceux qui sont spécialement destinés à la mesure de la pression atmosphérique.
Manobaromètres étalons
La construction de tels appareils est justifiée par les besoins de la thermométrie de précision : réalisation de points fixes de définition de l’échelle internationale pratique de température, études sur les thermomètres à gaz, ainsi que par la nécessité de disposer d’instruments pour étalonner des manomètres et baromètres d’usage courant, notamment les altimètres.
Tous utilisent la méthode rappelée ci-dessus (fig. 1) et, comme liquide, le mercure. La pression p1 dans la « chambre à vide » est maintenue aussi faible que possible au moyen de pompes à vide (pompe primaire et pompe à diffusion de mercure) ; elle est évaluée au moyen d’une jauge à vide (jauge de Pirani par exemple).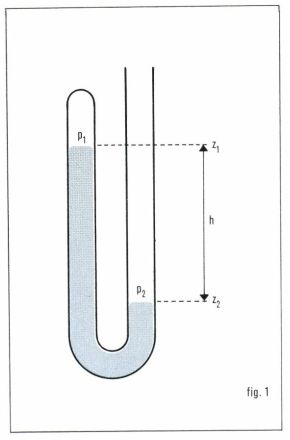
La masse volumique du mercure dans les conditions d’utilisation peut être connue à un millionième près environ en fonction de sa valeur à 20 °C et sous la pression atmosphérique normale (13 545,87 kg/m3), de sa température t, de son coefficient moyen de dilatation entre 20 °C et t et de son coefficient de compressibilité ; il faut en effet remarquer que la pression moyenne au sein de la colonne de mercure de mesure est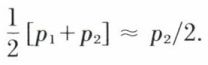
L’accélération due à la pesanteur est connue avec une précision du même ordre au moyen de mesures locales, absolues ou relatives.




